赫斯定律
簡介
赫斯定律是由俄羅斯化學家格爾曼·赫斯博士於1840年提出的,他在其中闡述了許多熱化學原理。赫斯定律是熱力學第一定律的結果,但由於其重要性而被單獨列為一條定律。該定律涉及反應熱的計算。
熱力學第一定律指出,特定反應中的焓變等於反應過程中吸收或釋放的能量。赫斯定律也處理化學反應的能量,它指出能量變化不依賴於反應途徑或所涉及的步驟,而是能量變化始終為常數。
什麼是赫斯定律?
赫斯定律指出,化學反應中涉及的焓變或能量變化與其途徑或所涉及的步驟數無關。這意味著能量變化的值始終是恆定的。無論反應是經過3個步驟還是4個步驟,能量變化都將相同。赫斯定律允許計算伴隨化學反應發生的焓變,其中能量變化未知。
焓值將取決於反應中涉及的分子數量,因為焓是一種廣延性質。因此,焓變也將取決於化學反應中涉及的分子數量。因此,即使反應採取不同的途徑或多個步驟,焓變也將相同。只需要知道初始狀態和最終狀態。
能量也以熱量的形式存在。因此,在放熱過程中,能量被釋放。而在吸熱過程中,能量被消耗。向前方向為放熱的反應,在反向方向上必須是吸熱的。透過這種方式,化學反應中的能量值是恆定的。
它也可以定義為任何化學過程的能量等於所有步驟的能量之和,即對於特定的化學反應,能量始終為常數。即總焓變,$\mathrm{\Delta\:H\:=\:\Delta\:H_{1}\:+\:\Delta\:H_{2}\:+\:\Delta\:H_{3}\:+\Delta\:H_{4}\:+\:\Delta\:H_{5}\:+\:\Delta\:H_{6}}$。它可以表示為:
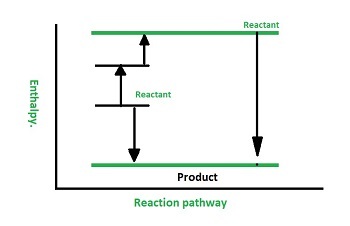
赫斯定律的示例
赫斯定律可以透過舉例子來說明。氫氣產生的化學過程為:
$$\mathrm{C(s)\:+\:2H_{2}O(g)\:\rightarrow\:CO_{2}(g)\:+\:2H_{2}(g)\:,\:\Delta\:H\:=\:90.1\:Kj}$$
此反應可以轉換為不同的步驟,如下所示:
$$\mathrm{C(s)\:+\:O_{2}(g)\:\rightarrow\:CO_{2}(g),\Delta\:H\:=\:-393.5Kj}$$
$$\mathrm{2H_{2}(g)\:+\:O_{2}(g)\:\rightarrow\:2H_{2}O(g)\:,\:\Delta\:H\:=\:-483.6\:Kj}$$
但焓變是恆定的,$\mathrm{\Delta\:H\:=\:90.1\:Kj}$。這可以透過下圖來說明。
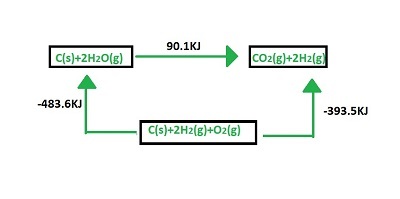
赫斯定律示例
涉及從硫生成三氧化硫氣體的反應的焓變可以用赫斯定律來解釋。
$$\mathrm{S\:+\:O_{2}\:\rightarrow\:SO_{2}\:,\:\Delta\:H_{1}\:=\:-70.96\:KCal/mol.}$$
$$\mathrm{SO_{2}\:+\:12O_{2}\:\rightarrow\:SO_{3}\:,\:\Delta\:H_{2}\:=\:-23.49KCal/mol}$$
$$\mathrm{\Delta\:H\:=\:\Delta\:H_{1}\:+\:\Delta\:H_{2}\:=\:-7096\:+\:-23.49\:=\:-94.95KCal/mol}$$
總反應中的焓變為:
$\mathrm{S\:+\:32O_{2}\:\rightarrow\:SO_{3}\:,\:where\:\:,\Delta\:H\:=\:-94.95KCal/mol}$
分步計算的焓變和淨反應中的焓變相同。
赫斯定律的應用
它是計算許多化學反應能量的重要理論。它在化學領域有許多應用。其中一些應用包括:
焓變計算 - 它可用於計算化學反應中的焓變,其中焓變未知。並由此我們還可以預測反應是放熱還是吸熱。如果值為負,則為放熱反應,如果為正,則為吸熱反應。
生成焓的計算 - 可以藉助赫斯定律計算未知的化學過程的生成焓。透過連續加減已知反應的焓值,我們可以很容易地1. 計算生成焓。例如,在由碳和氫構建苯的過程中,無法用常規方法計算生成焓。但是,藉助赫斯定律可以計算這些不可測量的性質。
與物理變化相關的焓變 - 可以計算某些無法計算焓變值的反應,這將是一個假設值。例如,在石墨轉化為金剛石的過程中,即使反應不可能發生,也可以計算焓變。
結論
赫斯定律是熱力學中的一條重要定律。即使它是熱力學第一定律的結果,但由於其特徵重要性而被單獨列為一條定律。根據該定律,無論採取多少步驟或反應完成的途徑如何,焓變始終是恆定的。這是因為焓是一個狀態函式。
赫斯定律有助於計算許多焓變未知的反應的總能量。生成焓也可以藉助赫斯定律確定。另一個重要的應用是計算與物理變化相關的焓變。
常見問題
1. 赫斯定律在什麼情況下不適用?
赫斯定律不能用於計算系統的熵。
2. 赫斯定律在現實生活中是如何應用的?
我們吃的食物透過一系列途徑轉化為能量。我們體記憶體在的碳水化合物轉化為二氧化碳和水。赫斯定律指出能量變化始終是恆定的,這意味著當我們鍛鍊時會釋放相同的能量,並被稱為燃燒卡路里。所以,這是赫斯定律的應用。
3. 什麼是熵?
熵是系統中隨機性或無序程度的量度。熵將評估系統中可用於做功的單位溫度下的熱能量。
4. 哪種型別的反應總是自發的?
自發反應是指焓變∆H為負且熵變∆S為正的反應。遵循此條件的系統被稱為自發反應。
5. 赫斯定律在汽車行業的應用是什麼?
汽車行業的工作基於赫斯定律,因為它們更側重於確定生產發動機所需的不同方法。藉助該定律可以檢查最有效的途徑。例如,汽車公司檢查汽油燃燒時發動機釋放的能量。
6. 哪條熱力學定律是赫斯定律的基礎?
熱力學第一定律是赫斯定律的基礎。
7. “ΔE”是什麼意思?
內能變化,也稱為恆容熱變化,用符號ΔE表示。


 資料結構
資料結構 網路
網路 關係資料庫管理系統
關係資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP