亨利定律
簡介
亨利定律是重要的氣體定律之一,由英國醫生和化學家威廉·亨利於1830年提出,以此命名以示敬意。該定律僅適用於稀溶液。該定律與其他理論相結合,在化學領域得到了廣泛應用。該定律關注特定體積下氣體在特定液體中的溶解。它將涉及溶解在液體中的氣體的重量。它描述了溶解氣體與分壓之間的關係。根據該定律,在恆溫下,它們成正比。
什麼是亨利定律?
亨利定律是一個氣體定律,因為它涉及氣體的性質。在恆溫下,對於一定體積的液體,溶解在其中的氣體量與液體上方氣體的分壓成正比。這意味著氣體和液體處於平衡狀態。溶解的氣體意味著它涉及氣體在液體中的溶解度。該定律可以用數學公式表示為:
$$\mathrm{C\alpha\:P_{gas}}$$
$$\mathrm{C\:=\:KP_{gas}}$$
其中:
$\mathrm{C\:=\:氣體的溶解度(ml,gas/L)}$
$\mathrm{K\:=\:亨利常數\:(M/atm)}$
$\mathrm{P_{gas}\:=\:氣體的分壓(atm)}$
亨利定律還指出,任何氣體的分壓都直接等於其摩爾分數。因此,我們可以給出亨利定律的另一個數學公式:
$$\mathrm{P_{gas\:\varpropto\:X}}$$
$$\mathrm{P_{gas}\:=\:KX}$$
其中:
$\mathrm{X\:=\:摩爾分數}$
什麼是摩爾分數?
摩爾分數或物質分數涉及溶液。它是溶液中溶質的摩爾數除以溶液中存在的總摩爾數。即:
$$\mathrm{摩爾分數\:=\:溶質的摩爾數\:/\:溶液中存在的總摩爾數}$$
摩爾分數和分壓之間的關係可以用圖表表示為:
當壓力恆定時?
當壓力保持恆定時,亨利定律也會發生變化。根據亨利定律,分壓和摩爾分數成正比:
$$\mathrm{P_{gas}\:\varpropto\:X\:或}$$
$$\mathrm{P_{gas\:=\:KX}}$$
如果壓力恆定,則方程式也會發生變化:
$$\mathrm{X\:\varpropto\:1/K}$$
即溶液的摩爾分數和亨利常數成反比。摩爾分數也與溶解度有關,因此亨利常數的增加會降低氣體在流體中的溶解度。
$$\mathrm{k\:\varpropto\:1/溶解度}$$
亨利常數與溫度的關係
氣體在液體中的溶解是一個放熱反應,即反應釋放熱量。因此,新增額外熱量或升高溫度會產生負面影響。溫度和氣體的溶解度成反比。即溫度升高會降低氣體在液體中的溶解度。數學上表示為:
$$\mathrm{T\:\varpropto\:1/溶解度}$$
但是
$$\mathrm{K\:\varpropto\:1/溶解度}$$
所以方程式變為:
$$\mathrm{t\:\varpropto\:K}$$
溫度和亨利常數成正比。溫度升高也會增加常數值。
影響亨利常數的因素
影響亨利常數值的一些因素包括:
系統的溫度,溫度升高會提高亨利常數值。
它取決於氣體的性質,不同氣體的值不同。
它取決於參與溶解的溶劑的性質。
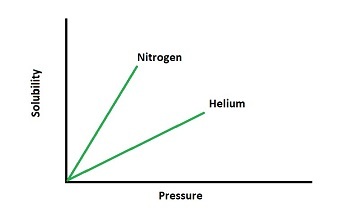
根據亨利定律,氣體在液體溶液中溶解度與壓力的關係圖
氣體的壓力和溶解度成正比。根據亨利定律,壓力對溶解度的影響因氣體而異。下圖顯示了壓力對溶解度的影響。
亨利定律的應用
該定律在現實生活中有很多應用,其中一些包括:
氧氣的溶解有助於生活在分壓較低的地區的人們呼吸。
軟飲料,特別是碳酸飲料的生產,是基於該定律。
潛水員的呼吸是基於該定律。
該定律也解釋了為什麼海洋生物更喜歡在寒冷的環境中生活。
濃度為稀溶液的溶液服從亨利定律。
亨利定律的侷限性
儘管它有很多應用,但也存在一些侷限性,它們是:
只有當系統處於平衡狀態時才適用。
它沒有考慮氣體在液體上溶解過程中發生的化學變化。
它取決於氣體的性質,即不與液體反應或溶解度較小的氣體。
需要特定的溫度和壓力才能驗證該定律。
結論
亨利定律是重要的氣體定律之一,在現實生活中有很多應用。根據該定律,一定氣體在特定液體中,在固定體積和恆溫下的溶解度直接等於處於平衡狀態的氣體和液體的分壓。即氣體在液體上的溶解度會隨著溫度和壓力的變化而變化。壓力升高會提高氣體的溶解度,但溫度升高會降低氣體的溶解度。還存在其他一些方面,例如氣體的特性、溶劑的特性等。儘管它解釋了許多現象,但也有一些侷限性。
常見問題
1. 哪些氣體不服從亨利定律?
氨氣和二氧化碳氣體溶解在水中時不服從亨利定律。這是因為氨氣和二氧化碳在水中的反應性。在這種情況下,它們的溶解度會很高。
2. 亨利定律與呼吸有什麼關係?
發生在我們體內的呼吸過程可以用亨利定律來解釋。即溶解在血液中的氧氣量與肺泡中氣體的分壓直接相關。
3. 理想溶液是否服從亨利定律?
理想氣體服從亨利定律,原因是理想氣體的情況下,溶質-溶質和溶質-溶劑之間的關係是不同的。
4. 拉烏爾定律是什麼?
拉烏爾定律斷言,溶液的分壓等於溶劑的摩爾分數與溶劑的分壓的乘積。它涉及溶液。
5. 為什麼氮氣在血液中的溶解度高於氦氣?
分壓的比較可以解釋這個過程,即氮氣的分壓比氦氣高。根據亨利定律,溶解度和分壓是相關的,因此氮氣的溶解度高於氦氣。這就是為什麼在潛水時氧氣瓶中使用氦氣的原因。


 資料結構
資料結構 網路
網路 關係資料庫管理系統(RDBMS)
關係資料庫管理系統(RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP