道爾頓分壓定律
介紹
根據氣體動理論,氣體擴散以充滿容器中佔據的空間,因為它沒有分子間相互作用。換句話說,氣體混合物中的粒子間隔足夠大,可以獨立於彼此而不會相互作用。由於沒有與其他物質粒子的相互作用,因此理想氣體的壓力是由其與容器的相互作用決定的,而不是由其與其他物質粒子的相互作用決定的。在不改變另一種氣體壓力的前提下,氣體會膨脹以充滿其所封閉的容器。因此,可以說氣體的壓力取決於其分子量、體積和溫度。混合物中不同氣體的溫度 (T) 和體積 (V) 是相同的,因為它們都包含在同一個容器中。容器中所含氣體的總壓力可以透過將每種氣體在系統中產生的壓力加起來計算。
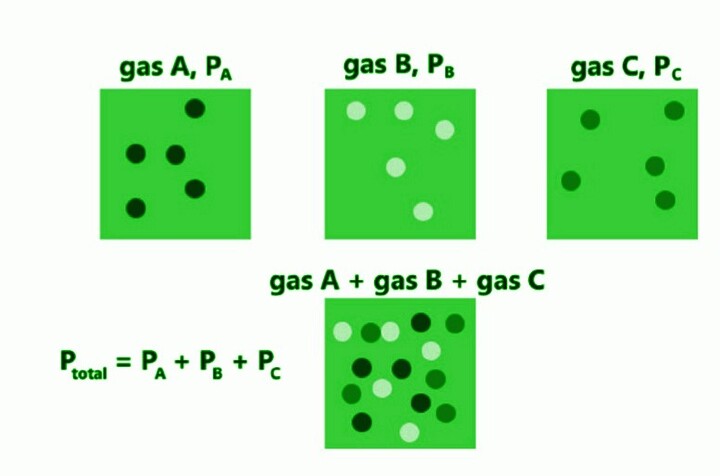
BlyumJ,描述道爾頓定律的示意圖,CC BY-SA 4.0
什麼是分壓?
特定氣體在其他氣體混合物中施加的壓力稱為該特定氣體的分壓。例如,如果一個容器包含3種氣體的混合物——氧氣、氮氣和CO₂——則其分壓等於氧氣對容器壁施加的壓力,其分壓等於氮氣和二氧化碳的分壓。混合物中O₂、N₂和CO₂的分壓之和對容器壁施加總壓力。
換句話說,構成氣體混合物的每種氣體都有一個分壓。這表示如果該氣體充滿初始混合物,則在相同溫度下的假設壓力。
氣體的分壓衡量其熱力學活性。氣體的分壓可以揭示其多種特性。例如,氣體的分壓會影響其在特定體積中的反應活性。即使是氣體的分壓也決定了它們的溶解和擴散方式。氣體的這一特性有助於我們理解和預測氣體在生物學中的化學過程。O₂和CO₂的分壓是動脈血氣分析的重要因素。
帶有下標中氣體符號的符號P代表氣體的分壓。例如,PO₂表示O₂的分壓。

什麼是道爾頓分壓定律?
英國科學家、物理學家和氣象學家約翰·道爾頓於1802年制定並首次發表了分壓定律。道爾頓分壓方程指出,氣體混合物的總壓力等於組成氣體分壓之和。道爾頓定律對於理想氣體混合物是精確的。因為它們距離相對較遠,理想氣體中的分子不能相互作用。真實的混合氣體在很大程度上遵循道爾頓定律。
例如,包含氮氣、氫氣和氧氣的理想氣體混合物將產生以下總壓力
$$\mathrm{P_{total}\:=\:P_{N_{2}}\:+\:P_{H_{2}}\:+\:P_{O_{2}}}$$
在這種情況下−
$\mathrm{P_{total}\:=\:理想氣體混合物的總壓力}$
$\mathrm{P_{N_{2}}\:=\:氮氣的分壓}$
$\mathrm{P_{H_{2}}\:=\:氫氣的分壓}$
$\mathrm{P_{O_{2}}\:=\:氧氣的分壓}$
讓我們來看一個額外的例子。氮氣和氧氣的混合氣體被放置在一個燒杯中。
如果O₂和N₂的分壓分別為148 mm Hg和590 mm Hg,則混合氣體產生的總壓力將為148 mm Hg + 590 mm Hg = 738 mm Hg。
摩爾分數和分壓
為了理解摩爾分數和分壓之間的關係,我們首先必須對摩爾分數有一個基本的瞭解。摩爾分數是混合物中一種氣體成分與所有其他氣體成分之和的比例。它用𝑥𝑖表示。
摩爾分數公式−
$$\mathrm{x_{i}\:=\:\frac{n_{i}}{n_{total}}}$$
$\mathrm{x_{i}\:=\:摩爾分數}$
$\mathrm{n_{i}\:=\:構成混合物的特定氣體的摩爾數}$
$\mathrm{n_{total}\:=\:混合物中每種成分的摩爾數之和。摩爾分數也稱為組分分數。}$
摩爾分數和分壓之間的關係
理想氣體混合物中某種氣體成分的摩爾分數可以表示為-
$$\mathrm{x_{i}\:=\:\frac{n_{i}}{n}\:............(1)}$$
其中𝑛𝑖是由每種氣體組成的理想氣體混合物的總摩爾數。n是理想氣體混合物中所有成分的摩爾數之和。
$\mathrm{摩爾分數\:=\:x_{i}}$
另一種表達理想氣體混合物中某種氣體的摩爾分數的方法如下−
$$\mathrm{x_{i}\:=\:\frac{p_{i}}{p}..........(2)}$$
其中𝑃𝑖是理想氣體混合物中每種氣體單獨的最佳分壓。P是最佳氣體混合物的總壓力。
$\mathrm{摩爾分數\:=\:x_{i}}$
方程(1)和(2)允許我們寫出-
$$\mathrm{x_{i}\:=\:\frac{n_{i}}{n}\:=\:\frac{p_{i}}{p}}$$
因此,理想氣體混合物中特定氣體的分壓可以表示為
$$\mathrm{P_{i}\:=\:x_{i}\:.\:p}$$
鑑於氣體混合物中氣體成分的體積分數與其摩爾分數相似,我們可以寫出-
$$\mathrm{\frac{P_{X}}{P_{total}}\:=\:\frac{V_{X}}{V_{total}}\:\frac{n_{x}}{n_{total}}}$$
其中𝑛𝑋=氣體成分X的摩爾數
𝑛𝑡𝑜𝑡𝑎𝑙 =混合物所有成分的總摩爾數。
𝑃𝑋 =X的氣體分壓。
𝑃𝑡𝑜𝑡𝑎𝑙是整個氣體混合物的壓力。
𝑉𝑋 =任何給定氣體成分X的分壓。
𝑉𝑡𝑜𝑡𝑎𝑙=混合物的總體積
結論
總之,我們可以說氣體混合物的總壓力等於每種氣體施加的分壓之和。因此,藉助道爾頓定律,我們可以計算每種氣體的分壓。但條件是氣體必須是非反應性的。
混合物的總壓力−
$$\mathrm{P_{total}\:=\:P_{gas\:1}\:+\:P_{gas\:2}\:+\:P_{gas\:3}}$$
道爾頓定律也可以用氣體的摩爾分數表示為:
$$\mathrm{P_{gas\:1}\:=\:x_{1}P_{total}}$$
常見問題
1. 道爾頓分壓定律的限制是什麼?
在低壓下,該定律對實際氣體有效,但在高壓下會發生顯著偏差。氣體混合物不以任何方式發生反應。還認為每種單個氣體的分子之間的相互作用與混合物中粒子之間的相互作用相同。
2. 哪種情況會排除道爾頓定律的使用?
由於NH₃和HCl是反應性氣體,因此道爾頓分壓定律不適用於它們,該定律僅適用於非反應性氣體。
3. 為什麼道爾頓分壓定律不適用於反應性氣體?
道爾頓定律僅適用於非反應性氣體的混合物,這意味著氣體不發生化學反應,並且只有在這種情況下,每種氣體的分壓之和才等於混合物的總壓力。道爾頓定律不適用於由反應性氣體組成的反應混合物,因為在這種情況下,氣體將沒有獨立的蒸汽壓,因此道爾頓定律將不適用於這些情況。
4. 道爾頓原子理論的主要論點是什麼?
根據他的理論的第一部分,原子——不可分割的——構成所有物質。理論的第二部分指出,特定元素中每個原子的質量和特性都是相同的。根據第三部分,化合物是由兩種或多種不同型別的原子結合而成的。
5. Kp和Kc——它們是什麼?
理想氣體混合物的平衡常數為Kp和Kc。當平衡濃度用大氣壓表示時,使用的平衡常數為Kp;當用摩爾濃度表示時,為Kc。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP