亨德森-哈塞爾巴爾赫方程
引言
亨德森-哈塞爾巴爾赫方程由Lawrence Joseph Henderson於1908年推導得出。該方程用於計算緩衝溶液的pH值。Karl Albert Hasselbalch於1917年將該方程改寫為對數形式。該方程的對數形式更為常用。緩衝溶液是由酸和鹽組成的混合物。緩衝溶液的特性是,即使新增酸或鹼,緩衝混合物的pH值也不會發生變化。
也就是說,它們具有抵抗pH值變化的能力。計算氫離子濃度從而檢查緩衝溶液的酸度是比較困難的。但是,亨德森-哈塞爾巴爾赫方程的出現使這一過程變得容易。
什麼是亨德森-哈塞爾巴爾赫方程?
亨德森-哈塞爾巴爾赫方程是酸鹼化學中一個重要的方程,可用於計算緩衝溶液的pH值。緩衝溶液對pH值的變化具有很強的抵抗力。緩衝溶液始終具有恆定的氫離子濃度,並且不會隨著鹼或酸的新增而改變。該方程給出了酸溶液的pH值與其相應的酸解離常數之間的關係,從而可以計算緩衝溶液的pH值。方程為:
$$\mathrm{pH\:=\:pKa\:+\:\log\:([共軛鹼]/[弱酸])}$$
$$\mathrm{pH\:=\:pKa\:+\:\log[A^{-}]/[HA]}$$
上述術語中,[HA]是弱酸的濃度,[𝐴−]是由質子損失形成的共軛鹼的濃度。使用該方程只能計算pH值的近似值。該值並非精確值,會存在少量偏差。無法計算強酸和強鹼的pH值。該方程的主要優點在於,由於緩衝溶液對pH值變化的抵抗力,計算其pH值是不可能的,並且它們在稀釋時也不會受到干擾,但藉助該方程,這已成為可能。它通常被稱為亨德森方程。
亨德森-哈塞爾巴爾赫方程的理論
化學家和生物學家利用亨德森-哈塞爾巴爾赫方程估算緩衝溶液的pH值。
該方程給出了溶液的pH和pOH以及pKa和pKb之間的適當關係。
首先利用該方程確定血液中碳酸氫鹽緩衝系統的pH值。
這是一種動力學分析,有助於計算緩衝溶液的酸度,而這在以前被認為是不可能的。
它是酸鹼化學中的一個重要方程。
它甚至用於計算製備相應緩衝溶液所需的pH值。
亨德森-哈塞爾巴爾赫方程的應用
該方程有很多應用。下面指出一些重要的應用。
它可以利用不同溶液的pKa值來計算pH值。
該方程可用於計算未解離和解離化學物質的濃度。
可以利用pH值計算溶液的pKa值。
可以利用從方程獲得的pH值來計算溶解度。
利用該方程計算蛋白質的等電點。
它用於確定生物分子的質子化狀態。
關於亨德森-哈塞爾巴爾赫方程的更多資訊
亨德森-哈塞爾巴爾赫方程還具有一些其他特性,例如:
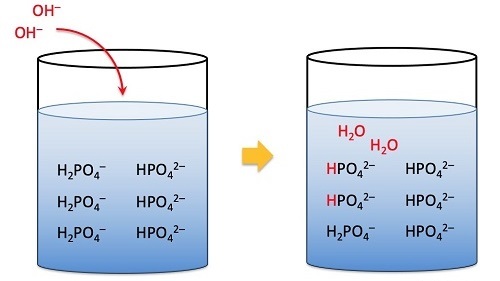
該方程可用於確定向緩衝液中新增少量酸或鹼時緩衝溶液的pH值的影響。
該方程還描述了緩衝溶液。
它還將描述共軛酸和鹼的相對強度。
該方程是酸鹼化學領域的一項突破,因為它可以計算緩衝溶液的pH值。
亨德森-哈塞爾巴爾赫方程的推導
以弱酸HA的解離為例,可以推匯出亨德森-哈塞爾巴爾赫方程。解離過程為:
$$\mathrm{HA\:+\:H_{2}O\:\leftrightarrows\:A^{-}\:+\:H_{3}O^{+}}$$
然後,可以計算解離常數Ka為:
$$\mathrm{Ka\:=\:[A^{-}][H_{3}O^{+}]/[HA]}$$
$$\mathrm{Ka[HA]/[A^{-}]\:=\:[H_{3}O^{+}]}$$
$$\mathrm{[H_{3}O^{+}]\:=\:Ka[HA]/[A^{-}]}$$
對等式兩邊取對數。方程變為:
$$\mathrm{\log\:[H_{3}O^{+}]\:=\:\log\:Ka\:+\:\log\:[HA]/[A^{-}]}$$
將上述方程乘以-1,將得到:
$$\mathrm{-\log\:[H_{3}O^{+}]\:=\:-\log\:Ka\:-\:\log\:[HA]/[A^{-}]}$$
已知:
$\mathrm{pH\:=\:-\log\:[H_{3}O^{+}]}$
以及 $\mathrm{pKa\:=\:-\log\:Ka}$
因此,將這些值代入上述方程,得到:
$$\mathrm{pH\:=\:pKa\:+\:\log\:[A^{-}]/[HA]}$$
這就是亨德森-哈塞爾巴爾赫方程。它用於估算緩衝溶液的pH值。當酸和共軛鹼的濃度相同時,pH和pKa相等。也就是說:
$$\mathrm{[HA]\:=\:[A^{-}]}$$
所以,$\mathrm{[A^{-}]/[HA]\:=\:1}$
因此,亨德森-哈塞爾巴爾赫方程變為:
$$\mathrm{pH\:=\:pKa\:+\:\log\:1}$$
也就是說:
$$\mathrm{pH\:=\:pKa}$$
這是從亨德森-哈塞爾巴爾赫方程獲得的另一個數學關係,可用於計算化學化合物的pKa值。
結論
亨德森-哈塞爾巴爾赫方程是化學(酸鹼化學)分支中的重要方程之一。幾年前,計算緩衝溶液的pH值是不可能的。但隨著該方程的出現,這已成為可能。該方程的形式最常用於計算緩衝溶液的pH值。該方程說明了pH和pKa之間的關係。它不僅可以計算緩衝液的pH值,還可以用於其他應用,例如濃度計算、pKa值計算等。它是藉助弱酸情況下的pH值計算推匯出來的。方程為:$\mathrm{pH\:=\:pKa\:+\:\log\:[A^{-}]/[HA]}$。
常見問題
1. 亨德森-哈塞爾巴爾赫方程的侷限性是什麼?
由於該方程未考慮水的自解離,因此無法利用該方程確定極稀溶液的緩衝溶液。此外,它不適用於強酸和強鹼。
2. 體積在亨德森-哈塞爾巴爾赫方程中重要嗎?
亨德森-哈塞爾巴爾赫方程只考慮酸和共軛鹼的濃度。因此,該方程與體積無關。
3. 為什麼緩衝容量很重要?
緩衝容量是與緩衝溶液相關的術語,它是緩衝溶液抵抗pH值變化的能力。這意味著緩衝液如何抵抗透過新增𝐻+或𝑂𝐻−離子而不會發生任何pH值變化。
4. 為什麼稀釋緩衝液不會改變pH值?
緩衝液的pH值取決於Ka和Kb值,而這些值不會隨pH值的變化而變化。此外,酸和鹽的濃度也不會改變,因此pH值不會隨稀釋而改變。
5. 緩衝液的例子有哪些?
緩衝液的例子包括碳酸和碳酸氫根離子、檸檬酸和檸檬酸鈉、乙酸和乙酸鈉等。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP