
- UPSC IAS 預備考試化學筆記(第一部分)
- 化學 - 首頁
- 我們周圍的物質
- 我們周圍的物質是純淨的嗎?
- 化學 - 原子與分子
- 化學 - 原子的結構
- 化學反應與方程式
- 化學 - 酸、鹼和鹽
- 材料:金屬和非金屬 I
- 化學 - 金屬與非金屬 II
- 碳及其化合物
- 元素的週期性分類
- 合成纖維和塑膠
- 化學 - 煤和石油
- 化學 - 燃燒和火焰
化學 - 原子的結構
介紹
到1900年,人們發現原子並非簡單的、不可分割的粒子,而是包含亞原子粒子。
J.J.湯姆遜發現了名為“電子”的亞原子粒子。

J.J.湯姆遜是第一個提出原子結構模型的人。
1886年,E.戈德斯坦在氣體放電中發現了新的輻射,並將其命名為陰極射線。
透過陰極射線的實驗發現了另一種帶正電的亞原子粒子,並將其命名為質子。
湯姆遜原子模型
湯姆遜提出,原子由一個帶正電的球體組成,電子(負電荷)嵌入其中(如下圖所示)。
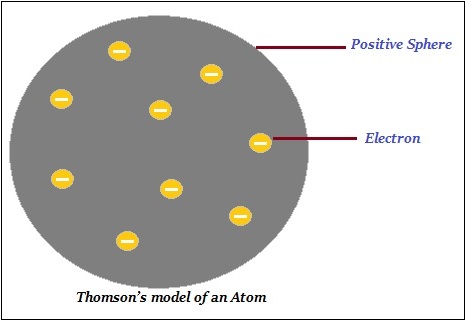
此外,湯姆遜說負電荷和正電荷在數量上相等。因此,原子整體上是電中性的。
盧瑟福原子模型
E.盧瑟福被譽為核物理學的“鼻祖”。

盧瑟福主要以其在放射性方面的研究以及透過金箔實驗發現原子核而聞名(如下圖所示)。
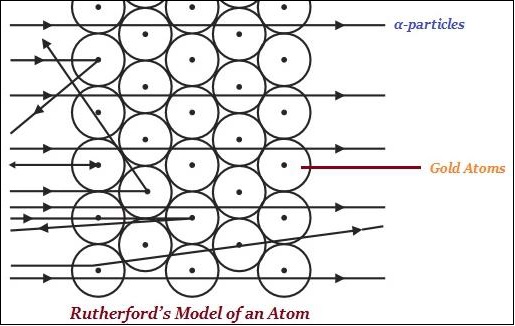
盧瑟福說,在一個原子中,存在一個帶正電的中心,稱為原子核。
盧瑟福說,幾乎所有原子的質量都存在於原子核中。
根據盧瑟福的理論,電子在明確定義的軌道上繞原子核旋轉。
玻爾原子模型
尼爾斯·玻爾進一步擴充套件了盧瑟福的模型,並改進了其不足之處。

根據玻爾的理論,原子內部只允許存在某些特殊的軌道,稱為電子的離散軌道。
玻爾說,電子在離散軌道上旋轉時不會輻射能量。
玻爾將軌道或殼層命名為能級(如下圖所示)。
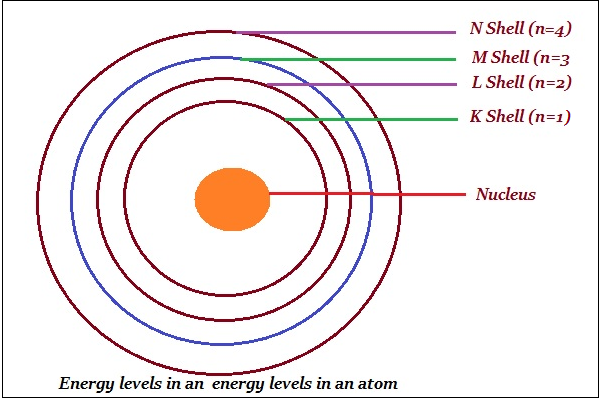
玻爾用字母 K、L、M、N……或數字 n = 1、2、3、4……表示這些軌道或殼層。
中子
1932年,J.查德威克發現了一種新的亞原子粒子,即中子。
中子不帶電,質量幾乎等於質子。
除氫原子外,所有原子的原子核中都存在中子。
電子分佈在不同的軌道(殼層)
殼層中最多可以容納的電子數由公式2n2給出。
‘n’是軌道數或能級指數,即 1、2、3……
根據給定的公式:
第一軌道,即K 殼層將是 = 2 × 12 = 2
第二軌道,即L 殼層將是 = 2 × 22 = 8
第三軌道,即M 殼層將是 = 2 × 32 = 18
第四軌道,即N 殼層將是 = 2 × 42 = 32
同樣,最外層軌道最多可以容納 8 個電子。
除非內層殼層已滿,否則不會在給定的殼層中填充電子。這意味著殼層以逐步的方式填充;從內層殼層到外層殼層。
價電子
存在於原子最外層殼層的電子稱為價電子。
根據玻爾-伯裡模型,原子的最外層殼層最多可以有 8 個電子。
原子序數
原子核中質子的總數稱為原子序數。
原子的質子數決定了原子序數。
原子序數用‘Z’表示。
質子和中子統稱為核子。
質量數
原子核中質子和中子總數之和稱為質量數。
同位素
具有相同原子序數但質量數不同的同一種元素的原子稱為同位素。例如,氫原子有三種同位素:氕、氘和氚。
原子的同位素的化學性質相似,但物理性質不同。
同量異位素
具有不同原子序數但質量數相同的不同元素的原子稱為同量異位素。例如,鈣的原子序數為 20,氬的原子序數為 18;此外,這些原子中的電子數不同,但這兩個元素的質量數均為 40。