
- UPSC IAS 預備考試化學筆記(第一部分)
- 化學 - 首頁
- 我們周圍的物質
- 我們周圍的物質是純淨的嗎
- 化學 - 原子與分子
- 化學 - 原子的結構
- 化學反應與方程式
- 化學 - 酸、鹼和鹽
- 材料:金屬和非金屬 I
- 化學 - 金屬與非金屬 II
- 碳及其化合物
- 元素的週期性分類
- 合成纖維和塑膠
- 化學 - 煤和石油
- 化學 - 燃燒和火焰
化學第一部分 - 快速指南
化學 - 我們周圍的物質
引言
宇宙中的一切都由某些物質構成,科學家稱之為“物質”。例如,我們吃的食物、我們呼吸的空氣、石頭、雲、星星、植物、動物、水、灰塵,所有的一切都被歸類為物質。
物質微粒的特性
物質微粒非常小,通常肉眼無法看到。
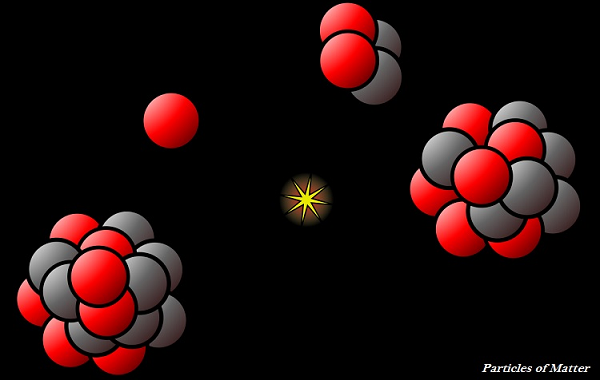
物質微粒不斷運動,這被稱為“動能”。
微粒的動能直接取決於溫度,溫度升高,運動速度也隨之升高。
物質微粒之間存在吸引力;因此,它們相互吸引。
微粒的吸引力將微粒結合在一起;然而,吸引力的強度因物質種類而異。
物質的狀態
物質有以下三種狀態:
固態
液態
氣態
讓我們簡要討論一下:
固態
所有固體物質都具有確定的形狀、明顯的邊界和固定的體積。
大多數固體物質的可壓縮性可以忽略不計。
所有固體物質在受到外力作用時都具有保持其形狀的自然傾向。
固體物質可以在外力作用下斷裂,但很難改變其形狀,因為它們是剛性的。
液態
與固體不同,液體沒有固定的形狀;然而,它們具有固定的體積。
液體佔據其所盛容器的形狀。
液體具有流動和改變形狀的特性。
氣態
空氣形式的物質,既不是固體也不是液體,被稱為氣體。例如,氧氣、氮氣、氫氣等。
與固體不同,氣體沒有確定的體積和形狀。
諸如液化石油氣(LPG——用於烹飪);壓縮天然氣(CNG——用作車輛燃料)等氣體具有高可壓縮性;因此,大量的燃氣可以壓縮到一個小的氣瓶中,並可以方便地運輸。
氣體通常表現出非常快速地擴散到其他氣體中的特性。這就是我們能夠聞到(好聞或難聞)遠處氣味的原因。
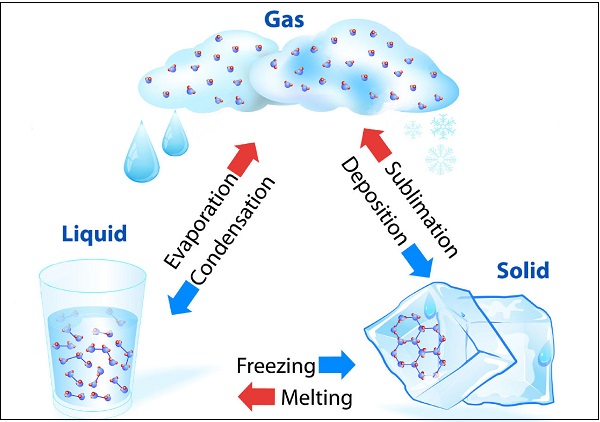
物質可以改變其狀態
水可以存在於三種狀態,例如冰為固態;水(H2O)為液態;水蒸氣為氣態。下圖說明了水在不同狀態下的轉化:
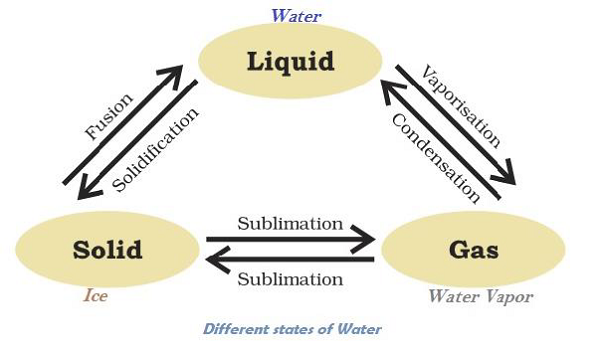
在給定大氣壓下,固體熔化並轉變為液體的溫度稱為“熔點”。
固體的熔點表明其微粒之間吸引力強度的指標。
冰的熔點為 273.16 K,即 00 C。
熔化過程(即固態轉變為液態)稱為熔化。
在給定大氣壓下,將 1 kg 固體材料轉變為液體材料所需的熱能稱為熔化潛熱。
在給定大氣壓下,液體開始沸騰的溫度稱為“沸點”。
水的沸點為 373 K,即 1000C。
物質直接從固態轉變為氣態而不轉變為液態(或反之)的狀態變化稱為“昇華”。
在低於其沸點的任何溫度下,液體轉變為蒸汽的現象稱為“蒸發”。
固體二氧化碳 (CO2) 在高壓下儲存。

一旦壓力降低到 1 個大氣壓,固體 CO2 會直接轉化為氣態。
大氣壓 (atm) 是測量氣體施加壓力的單位,壓力的單位是帕斯卡 (Pa);1 個大氣壓 = 1.01 × 105 Pa。
物質的第四態
等離子體是一種由超高能和超激發粒子組成的狀態。

超激發粒子以電離氣體的形式存在。例如,熒光管(含有氦氣)和霓虹燈(含有氖氣)包含等離子體。
化學 - 我們周圍的物質是純淨的嗎
引言
純淨物是由單一型別或型別的粒子組成的物質。

兩種或多種純組分混合物,不含任何不需要的物質,被稱為混合物,例如水、礦物、土壤等。
兩種或多種物質的均勻混合物被稱為溶液。例如,檸檬水、蘇打水等。
溶液可以是任何形式,例如液體、固體或氣體。
合金是混合物的另一個例子,它含有金屬的均勻混合物;它們不能透過物理方法分離成其組分。例如,黃銅是鋅(約 30%)和銅(約 70%)的混合物。
溶液的顯著特徵
溶液通常是均勻混合物。
溶液的粒子直徑甚至小於 1 nm(10-9 米),因此肉眼無法看到。
在溶液中,光的路徑不可見。
溶解的粒子不能透過簡單的過濾過程從混合物中分離出來。
溶解的粒子在靜置時不會沉澱。
在給定溫度下,當不再有溶質溶解在溶液中時,它被稱為“飽和溶液”。
在給定溫度下,飽和溶液中存在的溶解粒子的量稱為“溶解度”。
懸濁液
懸浮液是一種非均勻混合物,其中溶質粒子不溶解,而是懸浮在介質的大部分中,被稱為“懸浮液”。
懸浮液的顯著特徵
懸浮液的粒子肉眼可見。

懸浮液的粒子散射透過它的光束,並且它的路徑也是可見的。
溶質粒子可以透過簡單的過濾過程從混合物中分離出來。
膠體
非均勻混合物被稱為“膠體”。例如,霧、煙霧、煙、面霜等。

膠體粒子的尺寸太小,肉眼無法看到。
膠體粒子足夠大,可以散射透過它的光束,並使路徑可見。
膠體粒子不能透過簡單的過濾過程從混合物中分離出來。
特殊的過濾技術,即離心,可用於分離膠體粒子。
色譜法
分離混合物組分的過程稱為色譜法;通常用於顏色分離。
色譜技術用於分離溶解在相同溶劑中的溶質。
蒸餾
透過加熱和冷卻的方法提純液體的過程稱為蒸餾。
結晶
以晶體形式從溶液中分離純固體的過程稱為“結晶”。
元素
1661 年,羅伯特·博伊爾是第一個使用元素一詞的科學家;法國化學家安託萬·洛朗·拉瓦錫是第一個透過實驗定義元素一詞的人。
元素是物質的基本形式,不能透過化學反應分解成更簡單的物質。
元素通常可以分為金屬、非金屬和準金屬。
金屬
一種固體材料,通常堅硬、延展性好、可鍛造、有光澤、易熔,具有良好的導電性和導熱性,被稱為金屬。例如,金、銀、銅、鋁等。

汞是唯一在室溫下保持液態的金屬。
非金屬
所有不是金屬的元素或物質都稱為非金屬。例如,氫氣、氧氣、碘、碳等。
非金屬具有多種顏色,並且是熱和電的不良導體。
非金屬不具有光澤、聲響或延展性。
化合物
由兩種或多種元素組成的物質稱為“化合物”。
化合物是由兩種或多種元素以固定比例化學結合的結果。
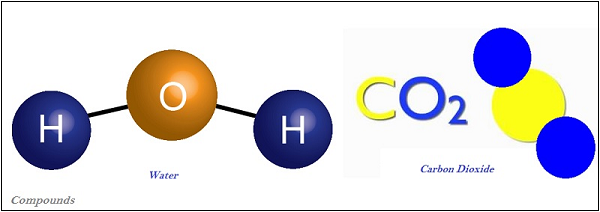
化合物的性質與其組成元素有所不同,而混合物的性質與其組成元素或化合物相同。
化學 - 原子與分子
引言
大約公元前 500 年,印度哲學家摩裡什·卡納德首次提出了物質不可分割部分的概念,並將其命名為“pramanu”。
1808 年,約翰·道爾頓使用了“原子”一詞,並將原子理論應用於物質的研究。

道爾頓原子理論
根據道爾頓原子理論,所有物質,無論是元素、化合物還是混合物,都由稱為原子的微小粒子組成。
根據道爾頓原子理論,所有物質,無論是元素、化合物還是混合物,都由稱為原子的微小粒子組成。
道爾頓原子理論的顯著特徵
所有物質都是由稱為原子的非常微小的粒子組成的。
原子是不可分割的粒子,不能透過化學反應產生或破壞。
一種元素的所有原子在質量和化學性質上是相同的,而不同元素的原子具有不同的質量和化學性質。
原子以簡單的整數比結合形成化合物。
在給定的化合物中,原子的種類和相對數量是恆定的。
原子質量
一個化學元素原子的質量;以原子質量單位 (符號為u) 表示。
原子質量大致等於原子中質子和中子的數量。
一個原子質量單位等於碳-12原子質量的十二分之一 (1/12),所有元素的相對原子質量都是相對於碳-12原子計算的。
分子
元素或化合物的最小粒子,能夠獨立存在並表現出相應物質的所有特性。
分子通常是由兩個或多個以化學鍵結合在一起的原子組成的。
相同元素或不同元素的原子可以(透過化學鍵)結合在一起形成分子。
構成分子的原子數稱為其原子性。
離子
帶電粒子稱為離子;它可以是負電荷或正電荷。
帶正電的離子稱為“陽離子”。
帶負電的離子稱為“陰離子”。
化學式
化合物的化學式表示其組成元素以及每種結合元素的原子數。
化合物的化學式是其組成的符號表示。
元素的化合能力稱為其“化合價”。
分子質量
物質的分子質量是透過將分子中所有原子的原子質量加和計算得到的。例如,水的分子質量計算如下:
氫的原子質量 = 1u
氧的原子質量 = 16 u
水分子含有兩個氫原子和一個氧原子。
水的分子質量 = 2 × 1 + 1 × 16 = 18 u (u是分子質量的符號)。
式量
物質的式量是透過將化合物一個式量單位中所有原子的原子質量加和計算得到的。
阿伏加德羅常數或阿伏加德羅數
阿伏加德羅是一位義大利科學家,他提出了阿伏加德羅數(也稱為阿伏加德羅常數)的概念。
1摩爾任何物質中存在的粒子(原子、分子或離子)的數量是固定的,其值始終計算為6.022 × 1023。
1896年,威廉·奧斯特瓦爾德提出了“摩爾”的概念;然而,摩爾單位直到1967年才被接受,為報告大量提供了一種簡單的方法。
質量守恆定律
在化學反應過程中,反應物和產物的質量總和保持不變,這被稱為“質量守恆定律”。
定比定律
在純淨的化合物中,其各元素的質量比總是恆定的,這被稱為“定比定律”。
化學 - 原子的結構
引言
到1900年,人們發現原子不是簡單的、不可分割的粒子,而是包含亞原子粒子的。
J.J.湯姆孫發現了亞原子粒子“電子”。

J.J.湯姆孫是第一個提出原子結構模型的人。
1886年,E.戈德斯坦在氣體放電中發現了新的輻射,並將其命名為陰極射線。
透過陰極射線的實驗,又發現了一種帶正電的亞原子粒子,並將其命名為質子。
湯姆孫原子模型
湯姆孫提出,原子由一個帶正電的球體構成,電子(負電荷)嵌在其中(如下圖所示)。
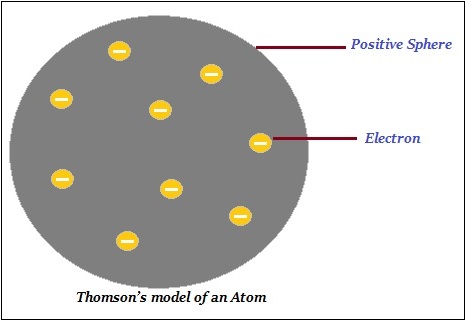
此外,湯姆孫說負電荷和正電荷在數量上相等。因此,原子整體上是電中性的。
盧瑟福原子模型
E.盧瑟福被稱為核物理學的“奠基人”。

盧瑟福因其在放射性和發現原子原子核方面的研究而聞名,這透過金箔實驗得以證實(如下圖所示)。
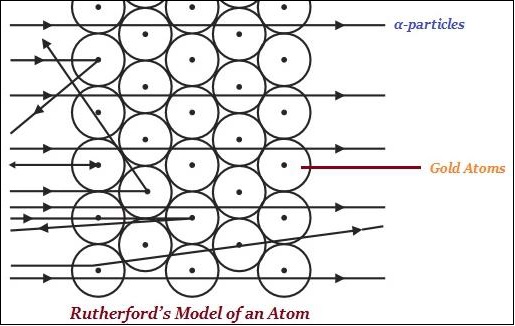
盧瑟福說,在原子中,存在一個帶正電的中心,稱為原子核。
盧瑟福說,幾乎所有原子的質量都存在於原子核中。
根據盧瑟福的理論,電子在明確定義的軌道上圍繞原子核旋轉。
玻爾原子模型
尼爾斯·玻爾進一步擴充套件了盧瑟福的模型並改進了其缺點。

根據玻爾的理論,原子內部只允許存在某些特殊的軌道,稱為電子的分立軌道。
玻爾說,電子在分立軌道上旋轉時不會輻射能量。
玻爾將軌道或殼層稱為能級(如下圖所示)。
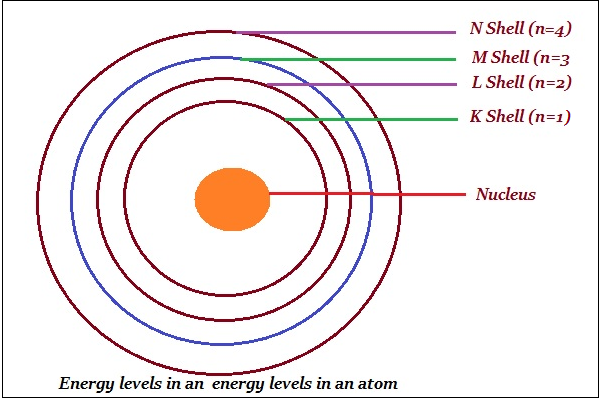
玻爾用字母 K、L、M、N……或數字 n = 1、2、3、4……表示這些軌道或殼層。
中子
1932年,J.查德威克發現了一種新的亞原子粒子,即中子。
中子不帶電,質量幾乎等於質子。
除了氫原子外,所有原子的原子核中都存在中子。
電子在不同軌道(殼層)中的分佈
一個殼層中最多可以容納的電子數由公式2n2給出。
'n'是軌道數或能級指標,即 1、2、3……
根據上述公式:
第一軌道,即K殼層,將是 = 2 × 12 = 2
第二軌道,即L殼層,將是 = 2 × 22 = 8
第三軌道,即M殼層,將是 = 2 × 32 = 18
第四軌道,即N殼層,將是 = 2 × 42 = 32
同樣,最外層軌道最多可以容納8個電子。
除非內層殼層已充滿,否則電子不會填充到給定的殼層中。這意味著殼層是逐步填充的;從內層殼層到外層殼層。
價電子
存在於原子最外層殼層的電子稱為價電子。
根據玻爾-布里模型,原子的最外層殼層最多可以有8個電子。
原子序數
原子核中質子的總數稱為原子序數。
原子的質子數決定了原子序數。
原子序數用'Z'表示。
質子和中子統稱為核子。
質量數
原子核中質子和中子總數之和稱為質量數。
同位素
具有相同原子序數但質量數不同的相同元素的原子稱為同位素。例如,氫原子有三種同位素:氕、氘和氚。
原子的同位素的化學性質相似,但物理性質不同。
同量異位素
具有不同原子序數但質量數相同的不同元素的原子稱為同量異位素。例如,鈣的原子序數為20,氬的原子序數為18;此外,這些原子中的電子數不同,但這兩個元素的質量數均為40。
化學 - 化學反應與方程式
引言
一種或多種化學物質與其他化學物質發生反應並轉化為一種或多種不同物質的過程稱為化學反應。
化學方程式
化學方程式是化學反應的符號表示;它透過符號和公式表示。例如:
鎂 + 氧氣 = 氧化鎂
Mg + O2 = MgO
鎂和氧氣被稱為反應物,反應的結果,即氧化鎂,被稱為產物。
記住,化學反應產物中存在的元素的總質量必須等於反應物中存在的元素的總質量。
每種元素的原子數在化學反應前後始終保持相同。
化學反應型別
以下是主要的化學反應型別:
化合反應
分解反應
置換反應
讓我們簡要討論一下每個反應:
化合反應
當兩種或多種物質(即元素或化合物)反應形成單一產物時,這種反應稱為化合反應。例如:
CaO(s) +H2O(l)→Ca(OH)2(aq)
(生石灰) (熟石灰)
如上述反應所示,氧化鈣和水反應(或結合)形成單一產物,稱為氫氧化鈣。
除了產物的形成外,還會釋放熱量的化學反應稱為放熱化學反應。
分解反應
單一反應物分解成更簡單的產物的反應稱為分解反應。例如:

在上述反應中,硫酸亞鐵晶體(即 FeSO4·7H2O)加熱時會失去水,晶體的顏色也會發生變化。最終,它會分解成氧化鐵 (Fe2O3)、二氧化硫 (SO2) 和三氧化硫 (SO3)。
置換反應
一種元素取代或去除另一種元素的反應稱為置換反應。例如:
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(硫酸銅)(硫酸亞鐵)
在上例反應中,鐵從硫酸銅溶液中置換出銅,形成硫酸亞鐵。
氧化和還原
如果物質在反應過程中獲得氧氣,則稱為氧化。另一方面,如果物質在反應過程中失去氧氣,則稱為還原。例如:
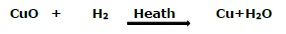
在上述反應中,氧化銅失去氧氣,因此被還原(即還原);另一方面,氫氣獲得氧氣,因此被氧化(即氧化)。
腐蝕
當金屬受到周圍環境中存在的物質(如水分、酸等)的侵蝕時,則稱為腐蝕。例如,銀上的黑色塗層、銅上的綠色塗層等。

酸敗
脂肪和油被氧化,這個過程稱為酸敗。它們的氣味、味道、顏色等也會發生變化;同樣,它使食物不適宜食用。
化學 - 酸、鹼和鹽
引言
食物嚐起來酸和苦,這僅僅是因為分別存在酸和鹼。
石蕊溶液
從地衣中提取的石蕊呈紫色(見下圖),但條件是當它既不是酸性也不是鹼性,即中性時。

石蕊基本上是一種屬於藻類植物的植物,在化學實驗中,它通常用作指示劑。
在酸性或鹼性介質中氣味發生變化的物質稱為嗅覺指示劑。
水溶液中的酸或鹼
HCl 中的氫離子是由於水的存在而產生的。其次,在沒有水的情況下,無法從 HCl 分子中分離出 H+ 離子。化學式如下所示
HCl + H2O → H3O+ + Cl–
此外,氫離子不能單獨存在,但它們可以在水分子存在下存在。因此,氫離子表示為 H+(aq) 或水合氫離子 (H3O+)。化學式為:
H+ + H2O → H3O+
可溶於水的鹼稱為鹼。但並非所有鹼都溶於水。
如果將水加入濃酸中,會產生熱量。
將酸或鹼與水混合會導致單位體積內離子(即H3O+/OH–)濃度降低,此過程稱為稀釋。
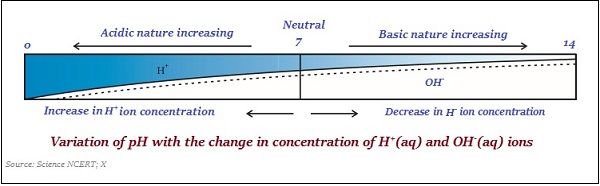
pH值
用於測量溶液中氫離子濃度的標度稱為pH值標度。
pH中的‘p’代表‘potenz’,這是一個德語單詞,意思是‘power’(冪)。
pH值只是一個數字,表示溶液的酸性或鹼性。因此,如果水合氫離子濃度越高,則pH值越低。
pH值的範圍在‘0’和‘14’之間;因此,如果測得pH值為‘0’,則表示其為強酸性;如果為14,則表示其為強鹼性。
pH值的中間值為‘7’。
在pH值標度上,小於7的值表示酸性溶液,大於7的值表示鹼性溶液。
通常,使用浸漬有常用指示劑的試紙來測量pH值(見下圖)−
同樣,酸和鹼的強度主要取決於分別產生的H+離子和OH–離子的數量。
下圖大致說明了一些常見物質的pH值(顏色變化)−
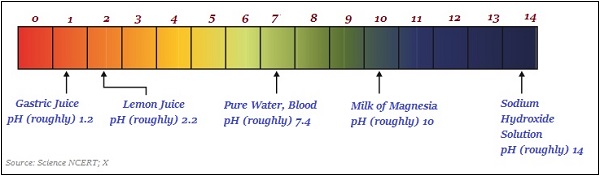
pH值在日常生活中的重要性
人體pH值的範圍在7.0到7.8之間。
人體胃部會產生鹽酸,有助於食物消化;令人驚訝的是,它不會損害胃部。
然而,當胃部產生過多的酸(稱為消化不良)時,會導致疼痛和刺激。為了緩解這種疼痛,醫生建議使用稱為抗酸劑的鹼性物質。
這些抗酸劑可以中和並控制過量的酸。
牙齒由磷酸鈣構成,是人體中最堅硬的物質。然而,當口腔中的pH值下降(低於5.5)時,會腐蝕牙齒。
鹽通常由鹽酸和氫氧化鈉溶液組合而成;這種組合被稱為氯化鈉。
當雨水的pH值測得小於5.6時,稱為酸雨。
當酸雨流入河流時,也會降低河水的pH值。
酸性河水對水生生物的生存構成威脅。
漂白粉
漂白粉是由氯作用於乾燥的熟石灰[Ca(OH)2]而產生的,其化學式為CaOCl2。
漂白粉通常用於紡織工業、造紙廠、化工行業以及飲用水的消毒。
小蘇打
小蘇打通常用於廚房,以烹飪美味酥脆的食物。它還可以使某些食物更快地烹飪。
小蘇打的化學名稱是碳酸氫鈉,化學式為NaHCO3。
蘇打灰
碳酸鈉的重結晶會產生蘇打灰。
蘇打灰的化學式為Na2CO3·10H2O。
蘇打灰通常用於玻璃、肥皂和造紙工業。
石膏
石膏是一種白色粉末,醫生用它作為骨折骨骼的固定石膏。
石膏的化學名稱是半水硫酸鈣,化學式為2CaSO4·H2O。
材料:金屬和非金屬 1
引言
金屬可以根據其化學和物理性質與非金屬區分開來。
金屬可以被錘打成薄片,這種性質稱為延展性。
金屬可以被拉成細絲,這種性質稱為延性。
金屬通常堅硬、具有延展性、光澤、延性、具有聲響性,並且是良好的導熱體和導電體。例如:鐵、銅、鈣、鋁、鎂等。

不具有聲響性且導熱和導電性差的材料稱為非金屬。例如:硫、碳、氧、磷等。
一些金屬,如鈉和鉀,質地柔軟,可以用刀切割。
汞是唯一一種在室溫下保持液態的金屬。
二氧化硫溶於水後會形成亞硫酸。舉例說明 - 二氧化硫 (SO2) + 水 (H2O) → 亞硫酸 (H2SO3)。
非金屬氧化物呈酸性。
亞硫酸會使藍色石蕊試紙變紅。
磷是一種非常活潑的非金屬,一旦暴露在空氣中就會著火。
為了防止磷與大氣中的氧氣接觸,磷儲存在水中。
燃燒時,金屬易與氧氣反應生成金屬氧化物,這些氧化物呈鹼性。
非金屬與氧氣反應生成非金屬氧化物;這些氧化物呈酸性。
一些金屬與水反應生成金屬氫氧化物和氫氣。
非金屬通常不與水反應。
金屬也與酸反應生成氫氣和金屬鹽。
非金屬通常不與酸反應。
金屬和非金屬的用途
金屬用於製造機械、飛機、汽車、火車、衛星、工業裝置、炊具、熱水器等。
非金屬用於肥料,以促進植物生長。
非金屬用於水淨化。
非金屬用於鞭炮。
化學 - 金屬和非金屬 2
引言
通常堅硬、可鍛造、有光澤、易熔和易拉伸的固體材料稱為金屬。例如:鐵、銅、鋁、鎂、鈉、鉛、鋅等。
金屬通常具有良好的導電性和導熱性。

純態的金屬具有閃亮的表面,稱為金屬光澤。
金屬可以被錘打成薄片;這種性質稱為延展性。
金屬可以被拉成細絲的性質稱為延性。例如:金是最具有延性的金屬。
銀和銅是最好的導熱體。
非金屬
非金屬通常以固體或氣體狀態存在。然而,溴是一個例外,它以液態存在。
一些主要的非金屬例子包括碳、硫、碘、氧、氫等。

金屬和非金屬的事實
除汞外,所有金屬在室溫下都以固態存在。
鎵和銫的熔點非常低;這兩種金屬甚至在手掌上就會熔化。
碘是一種非金屬,但它具有光澤(光澤是金屬的特性)。
碳是一種非金屬,可以以不同的形式存在。每種形式稱為同素異形體。
金剛石是碳的一種同素異形體,是已知最堅硬的天然物質。
金剛石的熔點和沸點非常高。
石墨也是碳的一種同素異形體;它是導電體。
鋰、鉀、鈉等鹼金屬是軟金屬的例子,因為它們可以用刀切割。
幾乎所有金屬與氧氣結合後都會形成金屬氧化物。
不同的金屬具有不同的反應頻率;有些反應緩慢,有些反應非常快。例如:鉀和鈉非常活潑,只要暴露在空氣中就會著火。
因此,鉀和鈉浸沒在煤油中以防止著火。
然而,在所有金屬中,鈉(最有可能)是最活潑的金屬。
陽極氧化是在鋁上形成厚的保護性氧化層以防止腐蝕的過程。
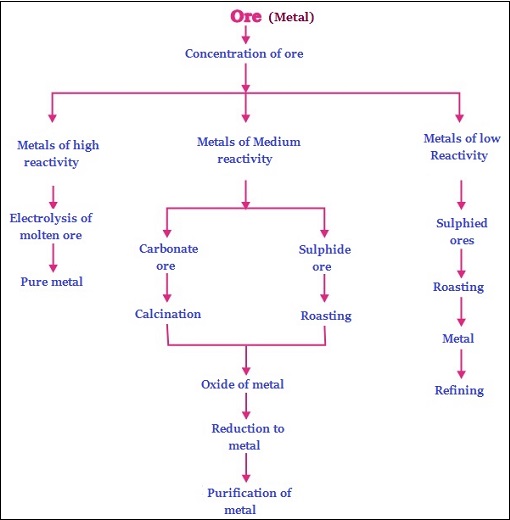
天然存在於地殼(上層)中的元素或化合物稱為礦物。
未加工狀態的礦物稱為礦石。例如:金、銀、鐵等。(下圖顯示了鐵礦石)−

從地球中提取的礦石通常含有大量的雜質,例如與某些元素、土壤、沙子等混合,稱為“脈石”。
根據反應性和從礦石中提取的情況,金屬可以分為−
化學 - 碳及其化合物
引言
碳對所有生物都起著非常重要的作用。
地球地殼中碳的含量僅為0.02%,以碳酸鹽、碳酸氫鹽、煤和石油等礦物形式存在。
地球大氣中碳的含量為0.03%,以二氧化碳的形式存在。
碳的化合物
幾乎所有碳化合物(少數例外)都是不良的導電體。
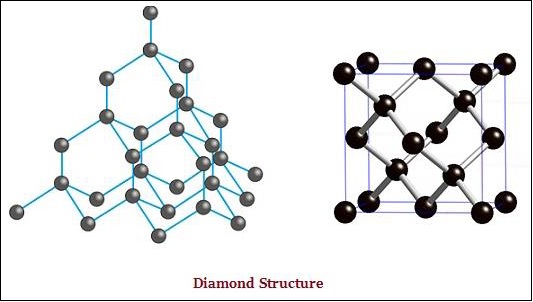
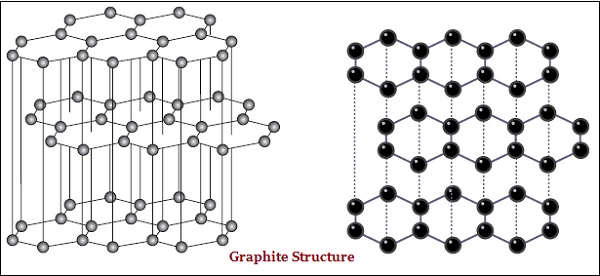
金剛石和石墨都是由碳原子形成的;然而,它們之間的區別在於碳原子相互鍵合的方式。
在金剛石中,每個碳原子都與其他四個碳原子鍵合,形成剛性的三維結構(見下圖)。
在石墨中,每個碳原子都與同一平面上的另外三個碳原子鍵合,形成六邊形陣列(見下圖)−
金剛石和石墨的一些物理結構也有所不同。
金剛石是已知最堅硬的物質,而石墨則是一種光滑且易滑的物質。
石墨是良好的導電體,而金剛石則不是。
下表列出了碳氫化合物的結構−
| 名稱 | 化學式 | 結構 |
|---|---|---|
| 甲烷 | CH4 | 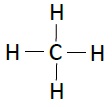 |
| 乙烷 | C2H6 | 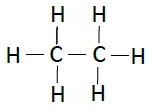 |
| 丙烷 | C3H8 | 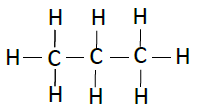 |
| 丁烷 | C4H10 | 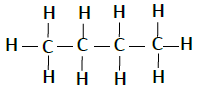 |
| 戊烷 | C5H12 | 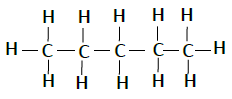 |
| 己烷 | C6H14 | 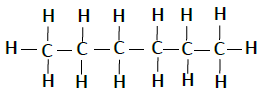 |
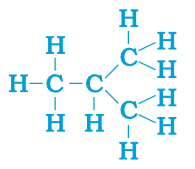
具有相同分子式但結構不同的化合物稱為結構異構體(見下圖所示的丁烷結構)。
飽和烴稱為烷烴。
含有一個或多個雙鍵的不飽和烴稱為烯烴。
含有一個或多個三鍵的不飽和烴稱為炔烴。
酒精作為燃料的用途
甘蔗植物非常有效地將陽光轉化為化學能,其汁液可用於製備糖蜜。
糖蜜發酵後會產生酒精(乙醇)。
一些國家現在使用酒精作為汽油的新增劑,因為它是一種更清潔的燃料。
這些酒精在充足的空氣(氧氣)中燃燒時,只會產生二氧化碳和水。
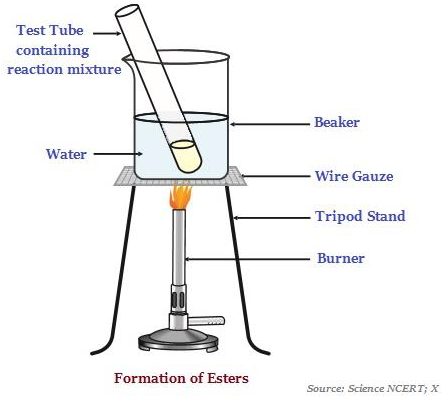
酯
酯是具有甜味的物質,最常見的是由酸和醇反應形成的(見下圖 - 說明酯的形成)。
酯在酸或鹼存在下反應,會重新生成醇和羧酸。
酯與酸或鹼的反應稱為皂化反應,因為它用於製備肥皂。
肥皂分子通常是長鏈羧酸的鈉鹽或鉀鹽。
有趣的是,肥皂的離子端溶於水,而碳鏈溶於油。肥皂分子的這種典型特徵形成了被稱為膠束的結構(見下圖)。
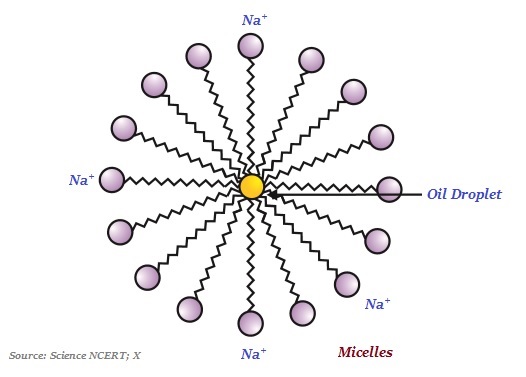
在膠束中,分子的一端朝向油滴,而離子端則留在外面。
肥皂膠束有助於溶解水中的汙垢;同樣,衣服也得到了清潔。
另一方面,洗滌劑通常是長鏈羧酸的銨鹽或磺酸鹽,即使在硬水中也能有效。
洗滌劑通常用於製造洗髮水和其他一些清潔衣物的產品。
元素的週期性分類
引言
到今天為止,我們已經知道大約有115種元素。
根據它們的性質,所有元素都按順序排列,稱為元素週期表。
德國科學家約翰·沃爾夫岡·多貝爾納於1817年首次嘗試排列元素。
英國科學家約翰·紐蘭茲也嘗試排列當時已知的元素(1866年)。
約翰·紐蘭茲遵循原子質量遞增的順序來排列元素。
紐蘭茲從原子質量最低的元素(如氫)開始,結束於釷,當時是第56號元素。

紐蘭茲的元素排列被稱為“八音律”,因為在他的排列中,每八個元素的性質與第一個元素相似。例如,鋰和鈉的性質被發現是相同的。
| Sa (do) | re (re) | Ga (mi) | Ma (fa) | Pa (so) | da (la) | ni (ti) |
|---|---|---|---|---|---|---|
| H | Li | Be | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
| Co & Ni | Cu | Zn | Y | In | As | Se |
| Br | Rb | Sr | Ce & La | Zr |
紐蘭茲還將其與音樂中發現的八度音程進行了比較(見上表)。
在印度音樂中,七個音符是—— *sa, re, ga, ma, pa, da, ni*;然而,在西方,音符是—— *do, re, mi, fa, so, la, ti*。
此外,為了將一些元素放入他的表中,紐蘭茲將兩個元素放在同一個單元格中(見上表——鈷和鎳放在同一個單元格中),但這並沒有奏效,因為它們的性質不同。
然而,八音律有一定的侷限性,因為它只適用於鈣;鈣之後,每八個元素的性質並不與第一個元素相似。
門捷列夫元素週期表
德米特里·伊萬諾維奇·門捷列夫,一位俄羅斯化學家,他成功地嘗試排列元素。
門捷列夫根據元素的基本性質——原子質量以及化學性質的相似性來排列元素。
在門捷列夫時代,只知道63種元素。
門捷列夫週期表由稱為“族”的縱列和稱為“週期”的橫行組成。

門捷列夫週期律指出:
“元素的性質是其原子質量的週期函式”。
門捷列夫以倒序排列,以便將具有相似性質的元素組合在一起。
門捷列夫為當時尚未發現的一些元素留下了空間;他大膽地預測了未來元素的存在。
門捷列夫週期公式最大的侷限性之一是——氫在元素週期表中沒有固定的位置。
現代元素週期表
1913年,英國物理學家亨利·莫塞萊發現,元素的原子序數比其原子質量更基本。
根據莫塞萊的發現,門捷列夫週期律得到了修改,原子序數被作為現代元素週期表的基礎。
現代週期律指出:
“元素的性質是其原子序數的週期函式”。
現代元素週期表定義了18列縱列,稱為“族”,和7行橫行,稱為“週期”。
在現代元素週期表中,元素的排列方式顯示了原子大小、化合價或化合能力以及元素的金屬性和非金屬性等性質的週期性。
在現代元素週期表中,金屬性沿週期遞減,沿族遞增。
另一方面,非金屬具有電負性,因為它們傾向於透過獲得電子來形成鍵。
在現代元素週期表中,非金屬位於右側(從頂部)。
化學——合成纖維和塑膠
引言
我們穿的衣服是由織物製成的,織物是由纖維製成的,纖維來源於天然或人工來源。
纖維的天然來源是棉花、羊毛、絲綢等,它們來自植物或動物。
合成纖維是由人類製造的;因此,這些被稱為合成纖維或人造纖維。
合成纖維通常是由連線在一起的小單元組成的鏈;每個小單元都是一種化學物質。
合成纖維的型別
人造絲通常被稱為人造絲。
人造絲(纖維)是透過對木漿進行化學處理獲得的。
由煤、水和空氣製成的纖維被稱為尼龍。

尼龍是第一種全合成纖維。
滌綸也是一種合成纖維;它是不易起皺的纖維。例如,特麗綸。
PET是滌綸的一種常見形式,用於製造餐具、瓶子、薄膜、電線以及許多其他有用的產品。
滌綸(聚酯)是由一種稱為酯的化學物質的重複單元組成的。
塑膠也像合成纖維一樣是一種聚合物。
聚乙烯(聚乙烯)是塑膠的一個常見例子。
有些塑膠,一旦成型,就不能透過加熱軟化;因此,這些被稱為熱固性塑膠。例如,酚醛樹脂和三聚氰胺。
酚醛樹脂是熱和電的不良導體;因此,它用於製造電開關、各種器皿的把手等。
三聚氰胺耐火,比其他塑膠更耐熱;因此,它用於製造地磚、廚房用具和織物。
透過自然過程(例如,細菌的作用)而分解的物質被稱為可生物降解的。
不能輕易被自然過程分解的物質被稱為不可生物降解的。
塑膠不利於環境。
化學——煤和石油
引言
自然界中數量無限,不太可能因人類活動而枯竭的資源被稱為取之不盡的自然資源。例如,陽光、空氣。
自然界中數量有限,可能因人類活動而枯竭的資源被稱為可枯竭的自然資源。例如,森林、野生動物、礦物、煤、石油、天然氣等。
可枯竭的自然資源是由生物的遺骸(化石)形成的;因此,這些自然資源也稱為化石燃料。例如,煤、石油和天然氣。
煤
煤堅硬如石,顏色為黑色。
煤是用來做飯的燃料之一。

煤用於火力發電廠發電。
在高壓和高溫下,埋在地球內部的死亡植物慢慢地變成了煤。
煤主要含有碳。
死亡植被轉化為煤的緩慢過程被稱為碳化。
煤是由植物殘骸形成的;因此,它也稱為化石燃料。
煤燃燒時,主要產生二氧化碳氣體。
煤在工業中加工時,會產生一些有用的產品,如焦炭、煤焦油和煤氣。
焦炭是一種堅硬、多孔的黑色物質。
焦炭是純碳。
焦炭主要用於鋼鐵製造和許多金屬的提取。
煤焦油是一種黑色、粘稠的液體,氣味難聞。
煤焦油是由大約200種物質組成的混合物。
從煤焦油中獲得的產品被用作製造日常生活中和工業中使用的各種物質的起始材料。例如,炸藥、油漆、屋頂材料、合成染料、藥品、香水、塑膠、照相材料等。
從煤焦油中獲得的萘丸用於驅除飛蛾和其他昆蟲。
從石油產品中獲得的瀝青用於代替煤焦油鋪路。
在煤加工製取焦炭的過程中,會得到煤氣。
1810年,英國倫敦首次使用煤氣進行街道照明,1820年,美國紐約也開始使用。
目前,煤氣被用作熱源。
石油
汽油和柴油是從一種稱為石油的天然資源中獲得的。
石油是由生活在海里的生物形成的。
數百萬年來(埋在地球內部的死亡生物),在高溫、高壓和無空氣的條件下,死亡生物轉化為石油和天然氣。
1859年,世界上第一口油井在美國賓夕法尼亞州鑽探成功。
1867年,在印度阿薩姆邦的馬庫姆發現了石油。
在印度,石油主要產於阿薩姆邦、古吉拉特邦、孟買高地、馬哈拉施特拉邦以及戈達瓦里河和克里希納河的流域。
下圖說明了氣體和石油的層狀分佈:
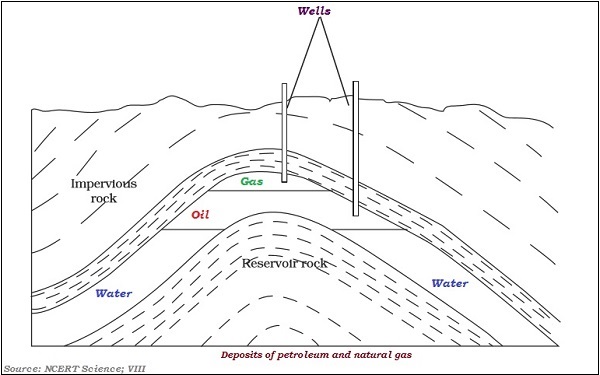
石油是由各種成分組成的混合物,例如汽油、石油氣、柴油、潤滑油、石蠟等。
分離石油各種成分的過程稱為精煉。
從石油和天然氣中獲得的不同有用物質被稱為“石化產品”。
石化產品用於製造洗滌劑、纖維(滌綸、尼龍、丙烯酸等)、聚乙烯和其他人工塑膠。
從天然氣中獲得的氫氣用於生產化肥(尿素)。
由於具有巨大的商業價值,石油也被稱為“黑色黃金”。
天然氣通常在高壓下儲存,因此被稱為壓縮天然氣 (CNG)。
CNG 用於發電和作為車輛燃料。
下表列出了石油的各種成分及其用途:
| 石油成分 | 用途 |
|---|---|
| 液態石油氣 (LPG) | 家庭和工業燃料 |
| 汽油 | 汽車燃料、航空燃料、乾洗溶劑 |
| 柴油 | 重型汽車燃料、發電機燃料 |
| 煤油 | 爐灶燃料、燈油和噴氣式飛機燃料 |
| 潤滑油 | 潤滑 |
| 石蠟 | 藥膏、蠟燭、凡士林等。 |
| 瀝青 | 油漆、路面鋪設 |
化學——燃燒和火焰
引言
一種物質與氧氣反應並放出熱的化學過程稱為燃燒。
進行燃燒的物質稱為可燃物或燃料。
燃料可以是固體、液體或氣體。
在燃燒過程中,光也會以火焰或輝光的形式釋放出來。

在燃燒過程中汽化的物質會產生火焰。
火焰有三個不同的區域:暗區、明亮區和非明亮區。
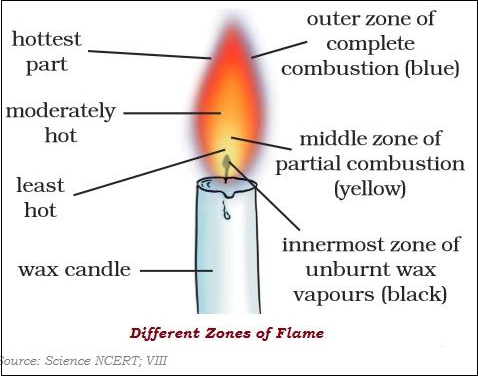
不同物質的著火溫度不同。
物質著火的最低溫度稱為其著火點。
火柴含有三硫化銻和氯酸鉀。
火柴的摩擦面含有玻璃粉和少量紅磷。
紅磷危險性小得多。
當火柴棒摩擦摩擦面時,一些紅磷轉化為白磷;該過程立即與火柴頭中的氯酸鉀反應,產生足夠的熱量來點燃三硫化銻;以此類推,燃燒開始。
著火點非常低,很容易著火的物質稱為易燃物質。例如汽油、酒精、液化石油氣(LPG)等。
滅火器
水是最常見的滅火器。
水作為滅火器,僅當木材和紙張著火時才有效。

如果電器著火,水可能會導電並損壞試圖滅火的人。
水也不是撲滅涉及油和汽油的火災的好滅火劑。
對於涉及電器和易燃材料(如汽油)的火災,二氧化碳(CO2)是最好的滅火劑。

獲得CO2的方法之一是釋放大量諸如碳酸氫鈉(小蘇打)或碳酸氫鉀之類的化學乾粉。
磷在室溫下在空氣中燃燒。
1公斤燃料完全燃燒產生的熱能稱為其熱值。
燃料的熱值以千焦每公斤(kJ/kg)為單位。
下表列出了不同燃料的熱值:
| 燃料 | 熱值 (kJ/kg) |
|---|---|
| 牛糞餅 | 6000-8000 |
| 木材 | 17000-22000 |
| 煤 | 25000-33000 |
| 汽油 | 45000 |
| 煤油 | 45000 |
| 柴油 | 45000 |
| 甲烷 | 50000 |
| 壓縮天然氣 (CNG) | 50000 |
| 液化石油氣 (LPG) | 55000 |
| 沼氣 | 35000-40000 |
| 氫氣 | 150000 |
大多數燃料的燃燒會向環境中釋放二氧化碳。
空氣中二氧化碳濃度的增加很可能是造成全球變暖的原因。
地球大氣溫度的上升稱為全球變暖。
全球變暖導致極地冰川融化,從而導致海平面上升,最終導致沿海地區發生洪水。
硫和氮的氧化物溶於雨水中形成酸;這種型別的雨水稱為酸雨。