
- UPSC IAS 預備考試化學筆記(第一部分)
- 化學 - 首頁
- 我們周圍的物質
- 我們周圍的物質是純淨的嗎
- 化學 - 原子與分子
- 化學 - 原子的結構
- 化學反應和方程式
- 化學 - 酸、鹼和鹽
- 材料:金屬和非金屬 I
- 化學 - 金屬與非金屬 II
- 碳及其化合物
- 元素的週期性分類
- 合成纖維和塑膠
- 化學 - 煤和石油
- 化學 - 燃燒和火焰
化學 - 酸、鹼和鹽
介紹
我們品嚐食物的酸味和苦味,僅僅是因為分別存在酸和鹼。
石蕊試液
石蕊是從地衣中提取的,呈紫色(見下圖),但前提是它既不是酸性也不是鹼性,即中性。

石蕊基本上屬於藻類植物,在化學實驗中常用作指示劑。
在酸性或鹼性介質中氣味發生變化的物質被稱為嗅覺指示劑。
水溶液中的酸或鹼
HCl 中的氫離子是由於水的存在而產生的。其次,在沒有水的情況下無法從 HCl 分子中分離出 H+ 離子。化學式如下所示
HCl + H2O → H3O+ + Cl–
此外,氫離子不能單獨存在,但它們可以在水分子存在的情況下存在。因此,氫離子表示為 H+(aq) 或水合氫離子 (H3O+)。化學式為:
H+ + H2O → H3O+
可溶於水的鹼被稱為鹼。但並非所有鹼都溶於水。
如果將水新增到濃酸中,則會產生熱量。
將酸或鹼與水混合會導致每單位體積離子的濃度(即 H3O+/OH–)降低,此過程稱為稀釋。
pH 值
用於測量溶液中氫離子濃度的標度稱為pH 值。
pH 中的“p”代表“potenz”,這是一個德語單詞,意思是“強度”。
pH 值只是一個數字,它表示溶液的酸性或鹼性。因此,如果水合氫離子的濃度越高,則 pH 值越低。
pH 值的範圍在“0”和“14”之間;因此,如果測得的 pH 值為“0”,則表示它是強酸性的;如果為 14,則表示它是強鹼性的。
pH 值的中性值為“7”。
在 pH 值標度上,小於 7 的值表示酸性溶液,大於 7 的值表示鹼性溶液。
通常,使用浸漬有常用指示劑的試紙來測量 pH 值(見下圖):
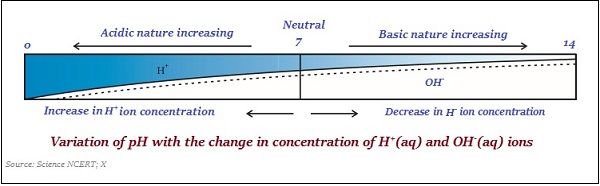
同樣,酸和鹼物質的強度主要取決於分別產生的 H+離子和 OH–離子的數量。
下圖大致說明了一些常見物質的 pH 值(顏色變化):
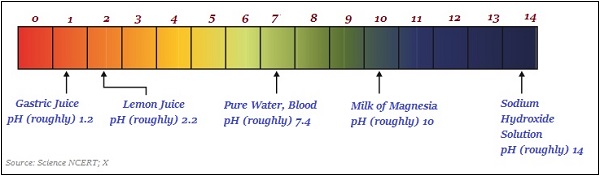
pH 值在日常生活中的重要性
人體 pH 值範圍在 7.0 到 7.8 之間。
人體胃部會產生鹽酸,有助於消化食物;令人驚訝的是,它不會損害胃。
但是,當胃產生過多的酸(稱為消化不良)時,會導致疼痛和刺激。為了緩解這種疼痛,醫生建議使用稱為抗酸劑的鹼。
這些抗酸劑可以中和並控制過量的酸。
牙齒由磷酸鈣構成,是人體中最堅硬的物質。但是,當口腔中的 pH 值下降(低於 5.5)時,它會腐蝕牙齒。
通常情況下,鹽是由鹽酸和氫氧化鈉溶液的結合形成的;這種結合被稱為氯化鈉。
當雨水的 pH 值小於 5.6 時,稱為酸雨。
當酸雨流入河流時,它也會降低河水的 pH 值。
酸性河水對水生生物的生存構成威脅。
漂白粉
漂白粉是由氯作用於乾燥的熟石灰 [Ca(OH)2] 而產生的,表示為 CaOCl2。
漂白粉通常用於紡織工業、造紙廠、化工行業以及飲用水的消毒。
小蘇打
小蘇打通常用於廚房,以烹製美味酥脆的食物。它還可以使某些食物更快地烹製。
小蘇打的化學名稱是碳酸氫鈉,化學式為 NaHCO3。
蘇打灰
碳酸鈉的重結晶會產生蘇打灰。
蘇打灰的化學式為 Na2CO3·10H2O。
蘇打灰通常用於玻璃、肥皂和造紙工業。
石膏
石膏是一種白色粉末,醫生用它作為支撐骨折骨骼的石膏。
石膏的化學名稱是半水硫酸鈣,化學式為 2CaSO4·H2O。