
- UPSC IAS 預備考試化學筆記(第一部分)
- 化學 - 首頁
- 我們周圍的物質
- 我們周圍的物質是純淨的嗎
- 化學 - 原子與分子
- 化學 - 原子的結構
- 化學反應與方程式
- 化學 - 酸、鹼和鹽
- 材料:金屬和非金屬 I
- 化學 - 金屬與非金屬 II
- 碳及其化合物
- 元素的週期性分類
- 合成纖維和塑膠
- 化學 - 煤和石油
- 化學 - 燃燒與火焰
化學 - 原子與分子
介紹
大約公元前 500 年,印度哲學家 महर्षि कणाद 首次提出了物質不可分割部分的概念,並將其命名為“pramanu”。
1808 年,約翰·道爾頓使用了“原子”一詞,並提出了原子理論來研究物質。

道爾頓原子理論
根據道爾頓的原子理論,所有物質,無論是元素、化合物還是混合物,都由稱為原子的微小粒子組成。
根據道爾頓的原子理論,所有物質,無論是元素、化合物還是混合物,都由稱為原子的微小粒子組成。
道爾頓原子理論的顯著特徵
所有物質都是由稱為原子的非常微小的粒子構成的。
原子是不可分割的粒子,在化學反應中既不能被創造也不能被破壞。
同一元素的所有原子在質量和化學性質上都相同,而不同元素的原子具有不同的質量和化學性質。
為了形成化合物,原子以小整數的比率結合。
在給定的化合物中,原子的相對數量和種類是恆定的。
原子質量
化學元素原子的質量;以原子質量單位(符號為u)表示。
原子質量大致相當於原子中質子和中子的數量。
一個原子質量單位是一個質量單位,等於碳-12原子質量的十二分之一(1/12),所有元素的相對原子質量都是相對於碳-12原子計算的。
分子
元素或化合物的最小粒子,能夠獨立存在並表現出相應物質的所有性質。
分子通常是由兩個或多個以化學鍵結合在一起的原子組成的。
相同元素或不同元素的原子可以(透過化學鍵)結合在一起形成分子。
構成分子的原子數稱為其原子數。
離子
帶電粒子稱為離子;它可以是負電荷或正電荷。
帶正電荷的離子稱為“陽離子”。
帶負電荷的離子稱為“陰離子”。
化學式
化合物的化學式表示其組成元素以及每種結合元素的原子數。
化合物的化學式是其組成的符號表示。
元素的結合能力稱為其“化合價”。
分子質量
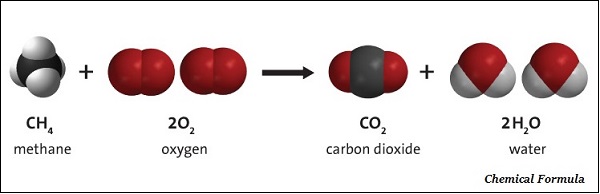
物質的分子質量是透過將相應物質分子中所有原子的原子質量加起來計算得到的。例如,水的分子質量計算如下:
氫的原子質量 = 1u
氧的原子質量 = 16 u
水包含兩個氫原子和一個氧原子。
水的分子質量 = 2 × 1 + 1 × 16 = 18 u(u 是分子質量的符號)。
式量
物質的式量是透過將化合物式量單位中所有原子的原子質量加起來計算得到的。
阿伏加德羅常數或阿伏加德羅數
阿伏加德羅是一位義大利科學家,他提出了阿伏加德羅數(也稱為阿伏加德羅常數)的概念。
1 摩爾任何物質中存在的粒子(原子、分子或離子)的數量是固定的,其值始終計算為6.022 × 1023。
1896 年,威廉·奧斯特瓦爾德引入了“摩爾”的概念;然而,摩爾單位於 1967 年被接受,以提供一種報告大量數字的簡單方法。
質量守恆定律
在化學反應中,反應物和產物的質量總和保持不變,這被稱為“質量守恆定律”。
定比定律
在純淨的化合物中,其元素總是以一定的質量比例存在,這被稱為“定比定律”。