陰離子系統分析
引言
系統地分析陰離子已成為富含定性性質的無機鹽的組成部分。整個分析過程服務於兩個目標之一:瞭解陰離子的種類和數量。
實驗目的
本實驗的目的是找出其陰離子形式中存在的總基團數。這種型別的基團在構成具有無機性質的鹽的混合物中非常常見。
理論
陰離子的系統分析旨在找出並確認構成酸鹼的不同型別的基團。由無機性質形成的鹽包含鹼性和酸性性質。酸性化合物具有一個體面的成分來定義它們的無機特性。由於存在“幾何形狀”,這種成分被稱為“結晶固體”。這組特性已知攜帶一些被稱為基團的電荷。鹽分析有兩個基本方面——其中一個是產物溶解度和共同離子效應。
實驗步驟
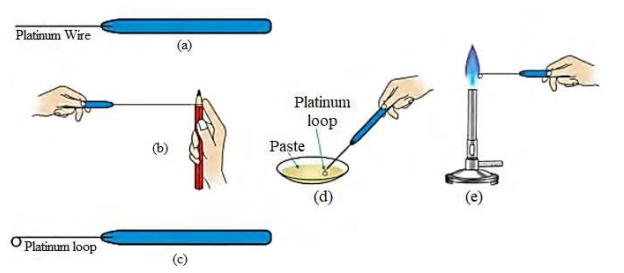
圖1 - 進行火焰測試
進行火焰測試,知識共享零,公共領域奉獻,透過維基共享資源
| 序號 | 實驗 | 觀察 | 推論 |
|---|---|---|---|
| 1 | 初步操作 | 本實驗中使用的鹽未觀察到明顯的顏色。 | $\mathrm{Fe^{2+}\:,\:Fe^{3+}\:,\:Ni^{2+}\:and\:Co^{2+}}$ 離子在反應的第一階段不存在。 |
| 元素的外觀和其他物理性質。 | 這些鹽的外觀主要體現在顏色差異上。包括綠色、棕色、粉色和藍色。 | 每種顏色的推論分別列出 - $\mathrm{Fe^{2+}\;,\:Ni^{2+}\:and\:Cu^{2+}}$. 棕色的推論是 Fe²⁺。如果鹽是粉紅色的,推論可能會有所不同,例如 $\mathrm{Co^{2+}\:and\:Mn^{2+}}$. 藍色鹽為 $\mathrm{Cu^{2+}}$。 | |
| 2 | 將觀察元素中是否存在某些熱量的作用。 | 觀察到的熱作用分為三種變化。該氣體無色,具有強烈而刺鼻的氣味,使紅色石蕊試紙變藍。石蕊試紙變藍是因為有紅棕色的蒸汽冒出。顏色隨溫度變化,冷時為白色,熱時為黃色。 | 無色氣體可產生 $\mathrm{NH_{4}^{+}}$ 鹽。對於紅棕色蒸汽,它們傾向於產生 $\mathrm{NO^{+}_{3}}$. 由於溫度引起的變色表明存在 $\mathrm{(Zn)^{2+}}$. |
| 3 | 步驟的第三步稱為火焰測試。在這個具體的測試中,少量濃鹽酸可以使鹽形成適當的糊狀物。將糊狀物放在本生燈火焰上。 | 該火焰測試的觀察結果分為四個部分。第一個是火焰開始呈蘋果綠色。第二個觀察結果是火焰呈深紅色。第三種顏色是磚紅色,最後一種是藍綠色。 | 推論分別表示為 $\mathrm{Ba^{2+}\:,\:Sr^{2+}\:,\:Ca^{2+}\:and\:Cu^{2+}}$ |
表1 - 實驗步驟
觀察結果
碳酸根陰離子 - 釋放的氣體是 $\mathrm{CO_{2}}$,具有非常強的泡騰現象。它們具有稀酸 $\mathrm{H_{2}SO_{4}}$,可以使石灰水變為乳白色。
圖2 - 幹法測試
硫離子 - 在溶液中加入一滴硝普鈉後,顏色會變成紫色或紫紅色。
亞硫酸根陰離子 - 透過用氯化鋇清除白色沉澱物來形成該陰離子的存在。當這種元素與稀鹽酸反應時,溶液會消失。另一個觀察結果是它開始釋放二氧化硫氣體。
注意事項
注意事項如下:
必須閱讀標籤以瞭解化學成分。
必須穿戴耐用織物製成的圍裙。
在高階人員和同伴的嚴格監督下聞化學蒸汽。
化學物質決不能接觸舌頭。
切勿嘗試在試管水中加入一滴酸。
切勿用裸手觸控試管,因為它們非常熱。
務必戴上安全護目鏡。
與化學物質和火保持安全距離,並應遵循預防措施。
結論
本教程解釋瞭如何使用鹽來檢視所用陰離子的總量。該步驟展示了正確進行此實驗的方法。由於某些離子的存在,無機鹽具有不同的顏色。最後,本教程以必須為確保每個人的安全而採取的基本預防措施結束。
常見問題
1. 共同離子效應對無機化學領域有何意義?
共同離子效應對有機化學領域的重要性在於,它與弱酸或弱鹼一起發揮作用,以防止其發生電離過程。
2. 陰離子的定性分析是什麼意思?
陰離子的定性分析已知可以對給定化合物中發現的陰離子和陽離子的數量進行正確的計數。也可以對單個元素進行這種分析分解,以達到尋找該元素中存在的陰離子和陽離子正確數量的相同目標。
3. 以基團形式存在的陰離子總數是多少?
以基團形式存在的陰離子總數共有兩個。其中一個是已知的 16 族,帶 -2 電荷。另一個被稱為 15 族,帶 -3 電荷。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP