磷化氫的製備、性質和用途
簡介
磷化氫在實驗室中透過使用白磷、氫氧化鈉並在二氧化碳的惰性環境中加熱來製備。磷化氫自然存在於人體的尿液、血液和唾液中。它在工業上有幾種應用,但也存在一些健康危害。
關於磷化氫的資訊
磷化氫被認為是一種有毒且易燃的元素,法國化學家透過在碳酸鉀水溶液存在下加熱磷 (P4) 發現了磷化氫。該實驗產生了具有魚腥味的無色氣體。磷化氫被認為是生物化學生命週期中的一種重要元素。由於該化合物在大氣中的濃度,該元素的化學性質非常不穩定。
磷化氫的結構
PH3 的結構幾何形狀為三角錐形。磷化氫的路易斯點結構包含一對孤電子對。磷原子的另外三個電子與三個氫原子共享,形成 PH3 分子的共價鍵。
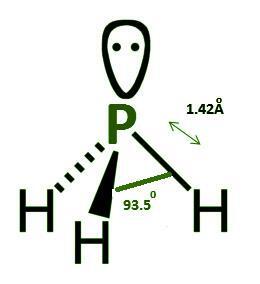
圖 1 - 磷化氫結構
此外,以下是磷化氫分子的重要事實:
磷和氮元素都位於元素週期表中的 15 族。PH3 的分子結構與 NH3(氨)相同。
磷的電負性低於氮。
磷化氫結構中 H-P-H 的鍵角為 95.3°。
P-H 的鍵長為 1.42 Å。
磷化氫的製備
磷化氫的製備分幾個步驟進行,具體步驟如下:
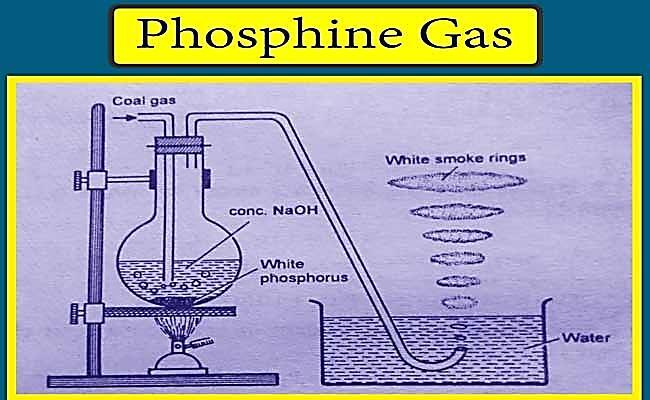
圖 2 - 磷化氫氣體的製備
金屬磷化物的酸鹼水解(例如磷化鈣) - 金屬磷化物與水或 HCl 溶液反應生成磷化氫。
由亞磷酸製備 - 亞磷酸 (H3PO3) 分解的過程可以透過純形式的磷化氫來表示。
由磷製備 - 該生產過程從加熱白磷開始,可以在 NaOH 溶液中生成 PH3,同時需要有 CO2 環境。
$$\mathrm{Ca_{3}P_{2}\:+\:6H_{2}O\:\rightarrow\:2PH_{3}\:+\:3Ca(OH)_{2}}$$
$$\mathrm{4H_{3}PO_{3}\:\rightarrow\:3H_{3}PO_{4}\:+\:PH_{3}}$$
磷化氫生成後,需要進行純化。P2H4 或 P4 的存在使磷化氫成為不易燃的氣體。吸收 HI 的過程可以將其轉化為 PH4I。因此,加入氫氧化鉀可以得到純淨的磷化氫。
$$\mathrm{PH_{4}I\:+\:KOH\:\rightarrow\:PH_{3}\:+\:KI\:+\:H_{2}O}$$
磷化氫的性質
磷化氫的性質可以分為以下兩種形式:
物理性質
氣體的氣味像腐爛的魚。氣體的沸點為 126°F,氣體的熔點等於 208.8°F。此外,它“微溶於水”。
該氣體的臨界溫度為 124.9°F。該氣體的比重為 1.203。用 PH3 表示。在 70°F 的溫度下,其液體密度為 35.50。
化學性質
根據與其他物質的反應,可以判斷 PH3 的化學性質。當它與 HBr、HI 和 HCl 發生反應時,可以生成含有鏻離子的化合物。
$$\mathrm{PH_{3}\:+\:HBr\:\rightarrow\:PH_{4}Br}$$
$$\mathrm{PH_{3}\:+\:HI\:\rightarrow\:PH_{4}I}$$
$$\mathrm{PH_{3}\:+\:HCl\:\rightarrow\:PH_{4}Cl}$$
這種氣體被認為是有毒氣體。即使少量接觸也會導致黃疸和頭暈等副作用。由於炎症、噁心、腦痛和疲勞,肝臟和腎臟等器官會出現問題。
磷化氫的應用
以下是 PH3 在不同行業中的重要應用:
在半導體行業,它少量用作摻雜劑。
由於具有自燃的特性,它被用在霍姆斯訊號中。
該氣體的應用可以產生金屬磷化物。
煙幕 - 磷化鈣在水中吸收磷化氫時會產生煙幕,在一些衝突中,它被用來掩護士兵不被敵人發現。
結論
磷化氫被認為是一種無色氣體,具有一些難聞的氣味。它被用於各種工業應用。磷化氫被認為是有毒的。該氣體本身並不易燃。但是,當與任何氧化性物質接觸時,它會燃燒甚至爆炸。它可以在實驗室中以各種應用進行製備。
常見問題
1. 稱為磷化氫的氣體的主要性質是什麼?
磷化氫的主要性質是:無色、有毒、溶於水,並具有難聞的魚腥味。
2. 磷化氫的結構是什麼?
磷化氫的幾何結構是三角雙錐形,其中 P 原子上有一對電子,以及三個 P-H 鍵,鍵長為 1.42 Å。
3. 磷化氫氣體如何在化學實驗室中製備?
白磷在 CO2 的惰性氣氛下用濃 NaOH 溶液加熱,生成 PH3。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP