氫氣的製備及其多種用途
引言
氫氣的製備在實驗室和商業規模上都涉及多個步驟。氫是宇宙中最豐富的元素,用途廣泛。
什麼是氫氣?
氫氣在宇宙中含量豐富,是重量最輕的元素。它是一種氣態、非活性元素,無色、無味、無臭且無毒。氫主要存在於水中或任何有機化合物中,也存在於動植物組織中。其獨特的特性使其廣泛應用於燃料、澱粉、酸和許多其他物質中。
氫氣的性質
以下是氫氣的性質:
物理性質:氫氣無色、無味、無臭。它是一種易燃氣體,但不助燃。氫的原子質量為1.008原子質量單位 (amu)。
化學性質:氫分子僅含一個H-H鍵,具有最高的鍵能。它與其他元素共享電子並形成共價鍵。由於鍵能高,氫在標準溫度下反應性較低。因此,氫氣的製備通常在電弧高溫或紫外線照射下進行。
氫氣的製備
氫氣的製備涉及以下步驟:
實驗室製備方法
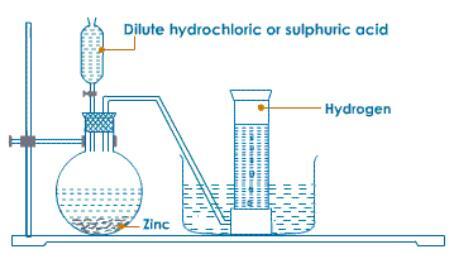
圖1 - 實驗室製備方法
在實驗室中,可以使用粒狀鋅和稀鹽酸製備氫氣。也可以透過使過量的鹼性水溶液與鋅反應來製備氫氣。反應方程式如下:
$$\mathrm{Zn\:+\:2NaOH\:\rightarrow\:\:+\:H_{2}}$$
工業製備方法
工業上製備氫氣的方法有以下幾種:
使用鉑電極電解酸化水,可以產生氫氣。
使用鎳電極電解溫熱的氫氧化鋇水溶液,可以得到高純度的氫氣。
在催化劑存在下,高溫下水蒸氣與烴反應可以產生氫氣。
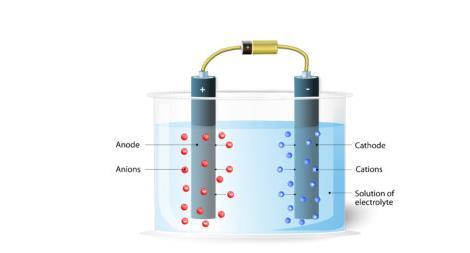
圖2 - 電解法工業製備方法
烴類可用於生產合成氣(也稱為水煤氣),水煤氣由一氧化碳和氫氣組成。合成氣存在於汙水、廢料和其他相關物質中。它也可以透過煤氣化技術從煤中提取。使用鐵鉻酸鹽等催化劑在加熱條件下,可以從烴類中提高氫氣的產量。合成反應方程式如下:
$$\mathrm{CH_{4}(g)\:+\:H_{2}O(g)\:\rightarrow\:CO(g)\:+\:3H_{2}(g)}$$
$$\mathrm{CO(g)\:+\:H_{2}O(g)\:\rightarrow\:CO_{2}(g)\:+\:H_{2}(g)}$$
氫氣的主要生產方法是使用烴類,少量則透過電解法生產。
其他方法
另一種製備氫氣的方法是催化水蒸氣-烴類法。將氣態烴類在高壓下與水蒸氣一起在鎳催化劑上處理,以產生一氧化碳和氫氣。反應如下:
$$\mathrm{C_{n}H_{2n\:+\:2\:+\:nH_{2}O\:\rightarrow\:nCO\:+\:(2n\:+\:1)H_{2}}$$
$$\mathrm{C_{n}H_{2n\:+\:2}\:+\:2nH_{2}O\rightarrow\:nCO_{2}\:+\:(3n\:+\:1)H_{2}}$$
另一個重要的氫氣生產過程是烴類在高壓下的非催化部分氧化。
$$\mathrm{C_{n}H_{2n\:+\:2}\:+\:(n/2)O_{2}\:\rightarrow\:nCO\:+\:(n\:+\:1)H_{2}}$$
氫氣的用途
以下是氫氣的用途:
用於合成氨,製造氮肥和硝酸。
用於製造植物油和不飽和人造黃油。
用於製造許多有機物質,特別是甲醇。
氫氣可用於生產氯化氫,這是一種有用的化學物質。
也用於製造金屬混合物。
氫氣在冶金過程中有助於將金屬氧化物還原為金屬。氫氣也可作為火箭燃料。
氫燃料電池也用於發電。與其他能源相比,它對環境沒有任何負面影響,這是一個優勢。
氧氫焰和原子氫焰也用於焊接鐵和鋼材料。
汽車工業正在進行大量關於使用氫燃料電池的實驗。
結論
氫氣是一種重要且獨特的元素,用途廣泛。它在電子構型、物理和化學性質方面與鹼金屬和鹵素相似。氫也存在於太陽和恆星的組成中。儘管這種元素的生產存在侷限性,但在自然界中它仍然非常豐富。
常見問題
1. 氫氣的用途是什麼?
氫氣是最重要的元素之一,可用作燃料電池、動力車輛和工業中的燃料發電。
2. 為什麼我們需要了解氫氣的製備?
瞭解氫氣的製備對於生命的存在以及許多其他用途都是必要的。它就像我們日常生活中大多陣列成部分一樣重要。
3. 氫氣的化學名稱是什麼?
化學名稱為氫氣,分子式為H2。原子符號為H,原子序數為1。
4. 氫氣是易燃氣體嗎?
氫氣本身不易燃,但它助燃。有時點火會引發火災。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統 (RDBMS)
關係型資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP