氧氣的製備、性質和用途
引言
氧氣是一種氧化劑,能與大多數元素和其他化合物容易地形成氧化物。它是元素週期表中氧族元素的成員,是一種高反應性的非金屬元素。在宇宙中,氧氣的丰度僅次於氫和氦,是地球上最豐富的元素。目前,地球大氣中約有20.95%是雙原子氧氣。地球地殼幾乎一半是由氧化物(氧的化合物)組成的。氧的原子序數為8,元素符號為O。

什麼是雙原子氧?
雙原子氧(O₂)是元素氧最常見的同素異形體之一,其分子中包含兩個氧原子。它通常被稱為氧氣,但也稱為雙原子氧、分子氧或氧氣,以區別於元素氧。臭氧(O₃)是已知的最強氧化劑之一,由於它不具有氯化水特有的味道,因此被用於淨化飲用水。除了惰性氣體外,幾乎所有元素都與氧氣發生反應。所得物質稱為氧化物。氧氣是燃燒所必需的,但它本身不可燃。氧氣是維持哺乳動物生命所必需的,因為它有助於能量的釋放,是一種生命之氣。
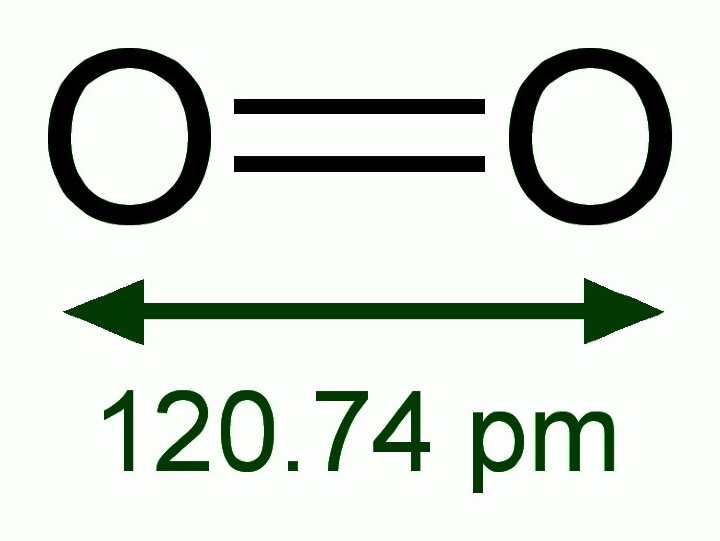
與14族和15族元素類似,16族中最輕的元素具有形成多重鍵的最大傾向。因此,元素氧在自然界中以O=O的雙原子氣體形式存在。
實驗室製備雙原子氧
雙原子氧可以透過多種方法在實驗室中製備。
富氧鹽如硝酸鹽和高錳酸鹽在熱分解時會產生雙原子氧。
氯酸鉀在二氧化錳的催化作用下熱分解產生雙原子氧。
電化學系列中電極電位相對較低的金屬氧化物,如氧化汞和氧化銀,在熱分解過程中也會產生雙原子氧。
過氧化氫分解也會產生氧氣,加入二氧化錳作為催化劑可以加快反應速度。
$$\mathrm{2KNO_{3}\:\rightarrow\:2KNO_{2}\:+\:O_{2}}$$
$$\mathrm{2KMnO_{4}\:\rightarrow\:K_{2}MnO_{4}\:+\:MnO_{2}\:+\:O_{2}}$$
$$\mathrm{2NaNO_{3}\:\rightarrow\:2NaNO_{2}\:+\:O_{2}}$$
$$\mathrm{2KClO_{3}\:\rightarrow\:2KCl\:+\:3O_{2}}$$
$$\mathrm{2HgO(s)\:\rightarrow\:2Hg(l)\:+\:O_{2}}$$
$$\mathrm{2PbO_{2}(s)\:\rightarrow\:2PbO(s)\:+\:O_{2}(g)}$$
$$\mathrm{2H_{2}O_{2}(aq)\:\rightarrow\:2H_{2}O(l)\:+\:O_{2}(g)}$$
工業製備
透過將潔淨乾燥的空氣流透過沸石分子篩,也可以製備雙原子氧。在N₂氣體被吸收後,提供的90-93%的氣體是氧氣。
電解水也能製備氧氣。在陰極釋放氫氣,在陽極釋放氧氣。
可以透過液態空氣的分餾法分離氧氣。首先去除水和二氧化碳。然後,氧氣以液態形式留下,氮氣(N₂)則以蒸汽形式蒸餾出來。
雙原子氧的性質
物理性質
其分子量為31.99 g/mol。為了方便使用,採用32 g/mol的摩爾質量。
它在水中溶解度很高(在293K時,100cm³水中溶解3.08cm³)。
它是一種無色無味的氣體。
在-183°C時,它是淺藍色的液體。
由於其密度為1.429 g/L,它比空氣密度大。
其沸點為-182.962°C。
其熔點為-218.79°C。
它具有順磁性。
化學性質
氧氣是一種高反應性元素,能與幾乎所有金屬和非金屬直接反應。一些金屬,如金和鉑,以及一些惰性氣體,如氦、氬和氖,沒有明顯的反應。
因此,大多數金屬和非金屬都能與其直接反應,生成相應的元素氧化物。
其性質為順磁性。
通常情況下,酸和鹼不會使氧氣發生反應。
氧氣是一種有效的氧化劑,有助於燃燒。
氧氣與潮溼作用會使鐵生鏽。
$$\mathrm{4Na\:+\:O_{2}\:\rightarrow\:2Na_{2}O(與金屬反應)}$$
$$\mathrm{C\:+\:O_{2}\:\rightarrow\:CO_{2}(與非金屬反應)}$$
$$\mathrm{燃料\:+\:O_{2}\:\rightarrow\:CO_{2}\:+\:H_{2}O}$$
$$\mathrm{Fe\:+\:O_{2}\:+\:H_{2}O\:\rightarrow\:Fe_{2}O_{2}.nH_{2}O(水合氧化鐵)}$$
雙原子氧的用途
雙原子氧是呼吸所必需的。
它被用於液體火箭燃料。
它以氧乙炔的形式用於切割和焊接金屬。
它可以用來生產硝酸。
醫院和登山用的氧氣瓶中含有它。
氧氣和乙炔氣體反應會產生氧乙炔火焰,用於切割和焊接金屬。
氧氣被用於淨化水,包括廢水處理和汙水處理方法。
臭氧用於雷射切割。
它與甲烷或二氧化碳一起用於人工呼吸。
氧氣用於燃燒過程。將氧氣與空氣混合可以促進燃燒,因為通常不燃燒的物質在氧氣中很容易燃燒。
結論
氧氣是一種高反應性的氣體,無色、無味、無嗅。在地球的地殼中,它並非以純淨的形式存在。由於其高電負性和反應活性,它與幾乎所有金屬和非金屬形成氧化物。可以透過加熱分解富氧物質如過氧化鋇、氯酸鉀、高錳酸鉀、硝酸鉀等來製備氧氣。也可以透過過氧化物和水來獲得氧氣。雙原子氧是可燃的和順磁性的。存在氫鍵。
氧氣是維持地球生命的重要組成部分。它是這個過程的核心。它用於水肺潛水、登山和醫院填充人工呼吸器。氧氣有廣泛的工業應用。它對包括鋼鐵在內的多種金屬的生產和焊接過程至關重要。
常見問題
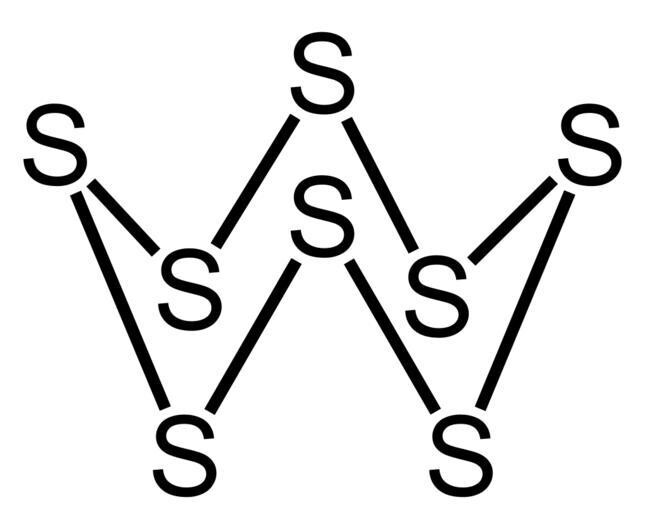
1. 為什麼硫是固體而雙原子氧是氣體?
由於小氧原子中較強的電子間斥力,O-O鍵比S-S鍵弱。此外,由於氧的電負性更高且原子半徑更小,它會形成p-p多重鍵。因此,它以氧分子存在,這些分子透過可忽略的範德華力結合在一起。在標準溫度下,氧氣是氣體。硫比其他元素不太可能形成p-p多重鍵。它也形成強S-S單鍵,原子半徑大,電負性低,這解釋了其增強的鏈增長和以具有褶皺環狀結構的S₈分子存在。因此,硫在室溫下是固體。
2. 臭氧是如何形成的?
我們可以透過在冷、幹、純氧中靜靜地放電來製造臭氧,使用特殊的裝置。這種裝置通常被稱為臭氧發生器。透過這種方法,我們可以生產濃度為10%的氣體。
3. 鹼金屬與氧氣反應會發生什麼?
鹼金屬(I族元素)與氧氣反應非常迅速。應將鹼金屬遠離氧氣以防止氧化。該族中最下面的金屬比最上面的金屬反應性強得多。較輕的鹼金屬生成超氧化物MO₂,而鋰和鈉分別生成一氧化物Li₂O和Na₂O。
4. 雙原子氧是化合物還是分子?
它由兩個透過共價鍵結合在一起的氧原子組成,因此它是一個雙原子分子。
5. 雙原子氧是一種藍色的氣體,對生命不重要。這是真的還是假的?
我們呼吸的氧氣是雙原子氧氣。這是一種無色、無味、無嗅的氣體。它對生命至關重要,因為植物和動物在代謝過程中使用它,代謝過程會燃燒食物成分以產生能量。因此,該說法是錯誤的。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP