苯胺黃的製備
介紹
苯胺黃是偶氮苯的衍生物,呈橙色粉末狀。它由 C. Mene 於 1861 年首次製備。1864 年,它作為第一個偶氮染料被商業化。它在水中微溶,可溶於乙醇、苯和油中。它是一種弱鹼,與無機酸形成鹽。
什麼是苯胺黃?
苯胺黃也稱為對氨基偶氮苯,透過偶氮染料的最簡單的偶聯反應獲得。由於其對酸敏感的性質,這種染料沒有工業意義。
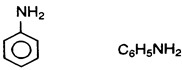
圖 1 - 苯胺的化學式
為了獲得純染料,透過將其溶解在四氯化碳溶劑中進行粗樣品的重結晶。可以使用簡單的石蕊試紙測試來識別苯胺黃。由於苯胺”呈鹼性,因此它會將紅色石蕊試紙變為藍色。
苯胺黃的用途
下面討論苯胺黃的用途:
它用於橡膠促進劑。
用作染料和中間體
用於除草劑和殺蟲劑。
用於石油精煉和炸藥
用於製藥和製造炸藥
苯胺的性質
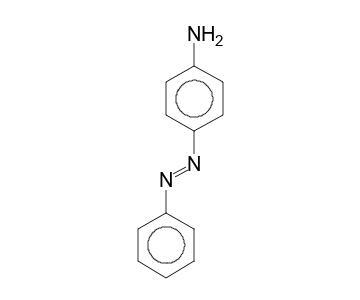
圖 2 - 苯胺黃的分子結構
它是一種黃色油狀液體,暴露在空氣或光線下會變暗。它還具有胺的氣味和灼燒的味道。它表現出弱鹼性,並在無機酸存在下形成鹽。苯胺黃的pH值為8.8。它是一個極性分子,充當氫鍵供體。其毒性會損害血紅蛋白,使其無法攜帶氧氣。
研究目的
目的是從苯重氮氯和苯胺製備苯胺黃。
苯胺黃生產理論
本研究提到了關於有效生產的一些有效理論。苯胺黃製備的第一階段始於苯的形成
從苯胺製備重氮氯。為此,苯胺在酸存在下用亞硝酸鈉處理。它產生苯重氮氯鹽。然後將該鹽與苯胺偶聯以產生對氨基偶氮苯的黃色沉澱,也稱為苯胺黃。它具有揮發性,並用作生產其他顏色的中間體。
製備過程的化學反應
下面討論了苯胺黃製備中涉及的化學反應。
步驟 1
$$\mathrm{Ar\:-\:NH_{2}\:+\:NaNO_{2}\:+\:HCl\:\rightarrow\:Ar\:-\:N_{2}^{+}\:.\:Cl^{-}}$$
步驟 2
$$\mathrm{Ar\:-\:N_{2}^{+}.Cl\:+\:Ar\:-\:NH_{2}\:\rightarrow\:Ar\:-\:N\:=\:N\:-\:NH\:-\:Ar}$$
步驟 3
$$\mathrm{Ar\:-\:N\:=\:N\:-\:NH\:-\:Ar\:\rightarrow\:Ar\:-\:N\:=\:N\:-\:Ar\:-\:NH_{2}}$$
在初始階段,苯胺”充當親核試劑,因此與苯重氮氯$\mathrm{C_{6}H_{5}N_{2}^{-}Cl^{-}}$反應形成 C-N 鍵。在下一步中,它失去其 H+ 離子並導致偶氮染料。
所需材料
下面討論了製備苯胺黃所需的材料:
苯胺
鹽酸 (鹽酸)
亞硝酸鈉
冰醋酸
本生燈
蒸餾水
圓底燒瓶
燒杯
攪拌器
漏斗
水浴
錐形瓶
程式
下面討論了製備苯胺黃的步驟:
取 10 毫升鹽酸與 20 毫升水混合,然後在混合物中加入 4 毫升苯胺。
完全溶解混合物
將溶液在冰浴中冷卻至約 5°C。
將 4 克亞硝酸鈉加入水中並攪拌直至完全溶解
將此溶液與苯胺溶液混合以製備苯重氮氯溶液
加入 4 毫升鹽酸並向苯重氮氯溶液中加入 4 毫升苯胺。這種偶聯反應導致苯胺黃的形成
為了獲得純染料,透過將其溶解在四氯化碳溶劑中進行粗樣品的重結晶。
形成純黃色沉澱,稱為苯胺黃,並將這種黃色沉澱透過布氏漏斗過濾並儲存乾燥。
注意事項
下面提到了此製備過程的注意事項:
不要觸控染料,因為它具有粘性。
實驗溫度應保持在 40° 至 50° 之間
實驗的 pH 值必須在 4 到 5 之間。
粗樣品必須用清水反覆清洗
在進行此實驗時,需要一些防護措施,例如實驗服、手套和護目鏡。硝基苯的還原是透過在酸性水溶液中使用鐵屑進行的。
結論
實驗溫度不得超過 50℃,以避免爆炸。但是,由於其對酸的敏感性,它沒有工業意義。苯胺黃是在酸性介質中苯重氮氯與苯胺偶聯產生的。從苯胺合成苯重氮氯是苯胺黃形成的第一步。隨後,透過苯重氮氯和苯胺的偶聯產生偶氮染料。
常見問題解答
1. 從化學上區分苯酚和苯胺?
透過簡單的石蕊試紙測試可以識別它。由於苯胺呈鹼性,因此它會將紅色石蕊試紙變為藍色,而苯酚呈弱酸性,因此它會將藍色石蕊試紙變為紅色。
2. 苯胺是比氨弱的鹼嗎?
苯胺是比氨弱的鹼,因為苯環在苯胺中的共振效應使得氮原子上孤對電子的可用性降低。
3. 重氮化是什麼意思?
它是亞硝酸與無機酸反應生成重氮鹽作為產物的反應過程
4. 苯胺黃是染料嗎?
它是一種黃色偶氮染料和芳香胺,也呈橙色粉末狀。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP