形式電荷及其性質
引言
形式電荷定義為賦予分子中一個原子上的電荷,假設所有化學鍵中的電子在原子之間平均分配,而不管相對電負性如何。或者,形式電荷也可以定義為原子在中性自由態下的價電子數與其在路易斯結構中所具有的電子數之間的差。形式電荷的公式為 − F=V-L-B/2,形式電荷是一個理論概念,它並不表示分子中任何真實的電荷分離。
什麼是形式電荷?
形式電荷用F.C.或q表示,是在考慮所有化學鍵中的電子在原子之間平均分配,而不管相關電負性如何的情況下,賦予分子中一個原子的電荷。簡單地說,我們可以將形式電荷定義為原子在中性自由態下的價電子數與其在路易斯結構中所賦予的電子數之間的差。當我們需要確定分子的最佳路易斯結構時,選擇的結構應使各個原子上的形式電荷儘可能接近於0。形式電荷可以被認為是確定分子內電荷分佈的一種工具。
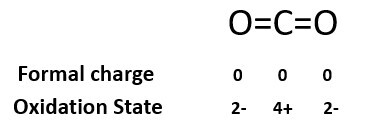
公式
分子中任何單個原子的形式電荷(q)可以透過以下公式給出:
$$\mathrm{F=V-L-B/2, }$$
其中,F=形式電荷(q),V=孤立中性原子價電子數,L=原子在分子中未成鍵價電子數,B=原子在分子中與其他原子共享的電子總數。
計算
我們知道形式電荷(q)=[原子上的價電子數]-[非鍵合電子數+鍵數]。
讓我們計算BH4中B的形式電荷,硼(B)的價電子數為+3,非鍵合電子數為零(0),硼(B)周圍的鍵數為4。因此,形式電荷(q) = 3-(0+4) = 3 - 4 = -1。
讓我們計算:CH3中C的形式電荷,碳(C)的價電子數為+4,非鍵合電子數為0,碳(C)周圍的鍵數為3。因此,形式電荷(q) = 4 - (0+3) = 4 - 3= +1。
重要性
形式電荷的一些重要性如下:
形式電荷(q)是一個理論概念,因此它不涉及或指示分子中任何真實的電荷(q)分離。
形式電荷在確定給定分子幾種可能的路易斯結構中能量最低的構型方面也起著至關重要的作用。
此外,瞭解最低能量結構對於指出反應的主要產物至關重要。
能量最低的結構通常是形式電荷最小且實際電荷分佈最廣的結構。
示例
讓我們以計算形式電荷為例。
1. 計算下列物質的形式電荷:
O3中的O原子
HClO4-離子中的Cl原子
F (形式電荷)=V(價電子)-L(非鍵合電子)-B(總電子數)/2
O1的形式電荷:6-2-6/2=+1。
O2的形式電荷:6-4-4/2=0。
O3的形式電荷:6-6-2/2=-1。
HClO4-離子中Cl原子的形式電荷:7-0-8/2=+3。
意義
分子中的一個原子必須具有零形式電荷才能具有最低能量,因此處於最穩定的狀態。
我們知道形式電荷(q)用於指示分子的首選結構(s),但是當存在許多同樣優選的結構時,問題變得更加困難。這是共振結構的情況。
分子的形式電荷(q)可以很容易地表明它在過程中將如何作用或表現。負形式電荷(-ve)表明該原子(a)更有可能成為反應中電子的來源(s)。
關於形式電荷的趣味事實
根據一些約定,形式電荷(q)對於描繪有機化學中完整正確的路易斯-凱庫勒結構很重要,但對於無機化學則不適用。
具有最低電荷量的分子的結構變化是最優越的。
結論
形式電荷,用q表示,定義為賦予分子中一個原子的電荷,假設所有化學鍵中的電子在原子之間平均分配,而不管相關電負性如何。或者,形式電荷也可以定義為原子在中性自由態下的價電子數與其在路易斯結構中所賦予的電子數之間的差。形式電荷(q)的公式為- F=V-L-B/2。它也用於從所有可能的結構中選擇能量最低的結構。
常見問題
1. 定義電負性。
電負性定義為化學元素原子在形成化學鍵時吸引共享電子的能力。
2. 中性態是什麼意思?
當物體或材料既不帶正電也不帶負電時,它就被認為處於中性狀態。
3. 描述路易斯結構。
路易斯結構,也稱為路易斯點結構或電子點結構,是顯示分子原子之間鍵合以及分子中可能存在的孤對電子的圖示。
4. 計算形式電荷的公式。
形式電荷(q)的公式為- F=V-L-B/2。
5. 形式電荷用於什麼?
形式電荷可以被認為是確定分子內電荷分佈的工具。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP