什麼是電解? - 定義、原理和過程
什麼是電解?
電解過程可以用多種方式定義:
利用直流電刺激非自發化學反應的技術稱為**電解**。
換句話說,透過離子物質傳遞電流將其分解成簡單物質的過程稱為**電解**。
或者,**電解**是基於電能可以產生化學變化的事實,即它可以導致化學反應發生的過程。
電解原理
電解的原理基於“**電解質**”這一術語。電解質是一種含有自由離子的物質,使該物質具有導電性。通常,電解質是離子溶液,但熔融電解質和固體電解質也存在。
在自然界中,電解質的原子緊密結合在一起,但當溶解時,這種鍵會變弱,電解質的分子會分裂成兩種型別的離子,即陽離子(帶正電的離子)和陰離子(帶負電的離子),在溶液中自由移動。
現在,如果將兩個電極浸入電解質中並連線到直流電源。然後,溶液中自由移動的陽離子會被陰極吸引,而溶液中自由移動的陰離子會被陽極吸引。
電解過程
為了理解電解過程,我們考慮以下示例。
考慮一個盛滿水的坩堝,其中浸入兩個電極,即陽極和陰極,這些電極由直流電源供電。電解過程的裝置如圖所示。
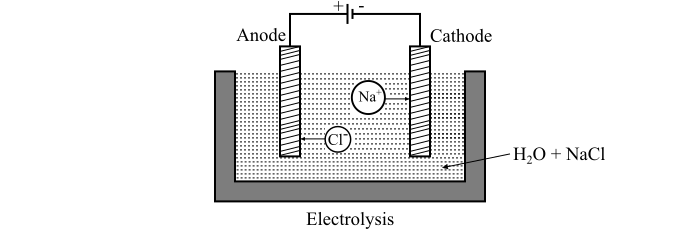
現在,當氯化鈉(NaCl)鹽溶解在水中時,它會分解成帶正電的Na+離子以及帶負電的Cl−離子,在溶液中自由移動。由於電極連線到直流電源,因此帶正電的Na+離子向陰極移動,而帶負電的Cl−離子向陽極移動。
到達陰極後,每個帶正電的鈉(Na+)離子從陰極獲取一個電子並形成鈉金屬。類似地,每個帶負電的氯離子會將一個電子傳遞給陽極,並停止成為陰離子。現在,沉積在陰極上的鈉金屬與水發生反應,並釋放出氧氣和氯化氫,即:
$$\mathrm{4Cl\: +\: 2H_{2}O\to 4HCL\: +\: O_{2}} $$
這種從水中氯化鈉(NaCl)中在陰極沉積鈉的過程稱為**電解**。
現在,如果陰極由鈉製成,則氯化氫會再次與鈉金屬反應,形成氯化鈉並釋放出氫氣。此過程也可以用以下化學反應表示。
$$\mathrm{2HCl\: +\: 2Na\to 2NaCl+H_{2}} $$
電解的應用
電解被廣泛用於:
精煉金屬,如金、銀、銅等。
從礦石中提取純金屬,如鋁、銅、鋅等。
各種電沉積過程,如電鍍、電鑄等。
製造各種化學品。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP