鈹和鋰的性質
介紹
鈹和鋰在物理和化學性質方面有所不同。它們的主要區別在於,鈹是抗磁性的,呈灰白色,而鋰是順磁性的,呈銀灰色金屬。它們形成兩種不同的二價和一價陽離子。
什麼是鈹?
鈹是一種鹼土金屬,原子序數為4,化學符號為Be。在宇宙中,它被認為是最稀有的化學元素之一。它呈灰白色。
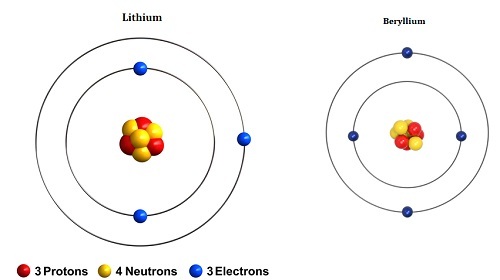
圖1 - 鋰和鈹的原子結構
鈹的價電子屬於s軌道;因此,它被稱為s區元素。鈹的電子構型為[He]2s2。這種金屬質地堅硬而脆,具有密排六方晶體結構。與第二族其他元素相比,這種金屬具有獨特的剛度和更高的熔點。
鈹的物理和化學性質
鈹的物理和化學性質如下:
物理性質
與第二族其他元素相比,鈹的沸點非常高。它仍然呈現出灰色的外觀。與第二族其他元素相比,它更硬,離子半徑更小。與其他鹼土金屬相比,它具有最高的電離焓。
化學性質
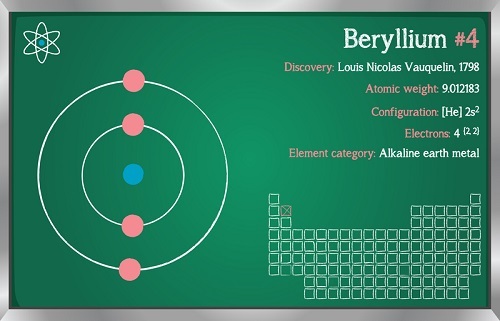
圖2 - 鈹的性質
鈹是鹼土金屬中唯一一種由於在金屬表面形成BeO層而對水惰性的元素。由於同樣的原因,它甚至不與空氣反應。鈹形成共價氫化物和鹵化物。它不與氫氣反應。
異常性質的原因 - 鈹的異常性質主要有兩個原因。第一個是鈹的原子尺寸非常小;因此,它不遵循鹼土金屬族的其他特性。第二個是鈹的配位數為4,而該族其他成員的配位數為6。
鈹與其他鹼土金屬的區別 - 與其他鹼土金屬相比,Be不與酸和水溶液反應。碳酸鈹呈不穩定形式,硝酸鈹呈無水狀態。
什麼是鋰?
鋰是一種鹼金屬,原子序數為3,化學符號為Li。與氫和氦一起,鋰被認為是在地球形成初期就存在的早期元素之一。燃燒時它會發出深紅色的火焰,但通常呈銀白色。
鋰的物理和化學性質
鋰的物理和化學性質如下:
物理性質 - 與第一族其他元素相比,它更硬。鋰的熔點和沸點分別為180.50°C和133°C。它被認為是最輕的金屬,也具有最小的離子半徑。與第一族其他金屬相比,它具有最高的電離焓。
化學性質 -

圖3 - 鋰的性質
與第一族其他元素相比,只有Li可以存在於穩定的氧化物分子中,這取決於金屬的原子或離子尺寸。它與水的反應不如第一族其他元素劇烈。在高溫下,鋰與氫反應,但溫度保持在約1073 K。鋰是一種強還原劑,它形成共價鹵化物。
異常性質的原因 - 鋰的異常性質主要有兩個原因。鋰最小的原子尺寸和非常高的極化能力使其與其他鹼金屬不同。
鋰與其他鹼金屬的區別 - 鋰可以形成水合物,而其他成員則不能。它可以形成碳酸氫鹽的固體化合物,這與第一族其他鹼金屬不同。硝酸鋰在適當的熱量下會分解成氧化鋰。
鋰和鈹都是非常重要和有用的元素。鋰用於生產不同型別的合金,其中一種是白金屬。鈹與銅混合可以生產出非常強大的彈簧。這兩種金屬都存在於元素週期表中的同一第二週期。
常見問題
1. 鋰和鈹的共同性質是什麼?
鋰和鈹屬於兩個不同的族,但兩者都有一些共同的性質。這些元素可以溶於水,並且在兩種情況下都表現出大量的原子半徑。由於它們的尺寸小,這些元素具有更好的電離能。與其他鹼金屬相比,這兩種元素都可以形成更好、更穩定的氫化物。
2. 鈹和鋁之間相似性的原因是什麼?
鈹和鋁的氧化物顯示出主要的酸性和兩性性質。這兩種元素都可以很容易地溶解在強鹼中形成可溶性絡合物。這些絡合物的形成是由於元素的極化能力。
3. 鈹和鋁之間的對角線關係是什麼?
對角線關係是指鈹和鋁的異常行為。這些元素表現出相似的行為,彼此之間的匹配程度超過它們所在族的成員。例如,這些元素的原子尺寸幾乎相等,即31pm。這些元素也具有相同型別的極化能力。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP