理想解
引言
溶液是由不同型別的化合物混合而成的。主要是溶質在溶劑中的**溶解**作用。溶液有兩種型別:**均相溶液和非均相溶液**。**溶液**的性質均勻的是均相溶液。
而性質不均勻的則為**非均相溶液**。許多定律與溶液有關。拉烏爾定律就是這樣一種定律。法國化學家弗朗索瓦-瑪麗·拉烏爾在1880年發現了**拉烏爾定律**,用於解釋理想溶液。該定律主要關注理想溶液的性質。但它也適用於一些非常稀的溶液。
什麼是理想溶液?
物質的混合物是溶液。理想溶液是拉烏爾定律在較寬濃度範圍內成立的均相混合物。**理想溶液**的物理性質與純物質(如溶質和溶劑)的性質呈線性關係。不同組分不同分子之間的相互作用與相同組分分子之間的相互作用相同。這意味著溶質和溶劑分子之間沒有特殊的反應或**相互作用**。這類似於理想氣體分子,這就是它被稱為理想溶液的原因。但與**理想氣體**分子不同的是,理想溶液中存在的分子之間會施加一定的力。當這些力相等時,該溶液就被認為是理想的。
溶液是由具有幾乎相同分子量和相同分子間力的物質混合而成的。即使形成了溶液,每個分子也很容易區分。對於這種溶液,溶液的焓值為零,即$\mathrm{\Delta\:H_{solution}\:=\:0}$。理想溶液可以透過溶解具有幾乎相同分子量的兩種物質來製備。例如,甲苯和苯的混合物將形成理想溶液,這是因為它們的分子量相似。

理想溶液的特性
理想溶液的特性非常獨特,這也是理想溶液非常重要的原因。下面指出了理想溶液的一些特性行為。
要形成溶液,必須有兩種不同的化合物,例如X和Y。這兩種化合物的溶解將導致某種**分子間力**。它們是$\mathrm{X\:-\:X\:,\:Y\:-\:Y,\:and\:X\:-\:Y}$相互作用。對於理想溶液,兩種化合物之間的所有相互作用都是相同的。
理想溶液的熱力學量,例如$\mathrm{\Delta\:_{mix}H\:=\:0\:and\:\Delta\:_{min}V\:=\:0}$。
用於製備理想溶液的化合物必須具有相似的**分子量和結構**。
分離理想溶液中存在的各個組分不需要任何複雜的過程,**簡單的分餾**即可用於分離。
在整個**濃度**範圍內,理想溶液都服從拉烏爾定律。
什麼是拉烏爾定律以及如何推導?
拉烏爾定律處理溶劑的分壓。根據拉烏爾定律,溶液的分壓等於真實溶劑的**蒸氣壓**與其所形成溶液的摩爾分數的**乘積**。用數學方法可以表示為:
$$\mathrm{P_{solution}\:=\:X_{solvent}\:P_{solvent}^{0}}$$
其中,
$\mathrm{X_{solvent}\:=\:溶劑摩爾分數}$
$\mathrm{P_{solution}\:=\:溶液蒸氣壓}$
$$\mathrm{P_{solvents}^{0}\:=\:純溶劑蒸氣壓}$$
對於由A和B溶解而成的混合物,拉烏爾定律的方程變為:
$$\mathrm{P_{A}\:=\:X_{A}\:P_{A}^{0}}$$
$$\mathrm{P_{B}\:=\:X_{B}\:P_{B}^{0}}$$
與溶液相關的總蒸氣壓可以計算為:
$$\mathrm{P_{r}\:=\:X_{A}\:P_{A}^{0}\:+\:X_{B}\:P_{B}^{0}}$$
這樣,就可以利用拉烏爾定律計算總蒸氣壓。
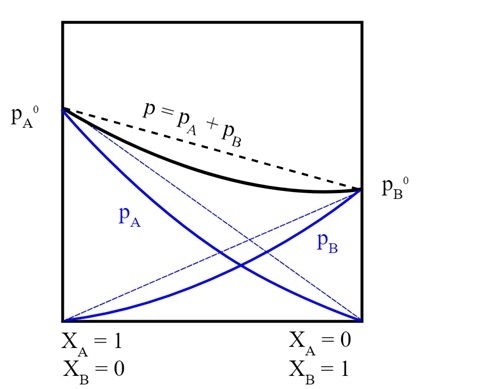
AngelVelOre, 真實溶液蒸氣壓, CC BY-SA 4.0
拉烏爾定律的重要性是什麼?
該定律有很多重要的方面。下面解釋了拉烏爾定律的一些重要性
拉烏爾定律解釋了**理想溶液**。
拉烏爾定律還解釋了混合物的蒸氣壓總是小於**真實溶劑**的蒸氣壓。
利用拉烏爾定律還可以解釋與**非揮發性溶質**相關的蒸氣壓。
拉烏爾定律解釋了所有固體和液體化合物都具有蒸氣壓。
拉烏爾定律解釋了液體和蒸氣粒子之間的動態平衡。
理想溶液的性質
下面幾點解釋了理想溶液的一些性質。
混合形成理想溶液的組分時,焓不會發生任何變化。
理想溶液中分子之間存在的相互作用與單個分子相互作用相同。這意味著溶質-溶質和溶質-溶劑相互作用是相同的。
理想溶液中各組分的活度等於摩爾分數。
溶劑的性質僅依賴於**溶質**粒子的濃度。
在理想溶液的情況下,**分子間力**不為零,但所有型別的相互作用都是相同的。
結論
理想溶液是一種不同於普通溶液的溶液。由於存在具有幾乎相同**結構和分子量**的組分,它們在某些行為上表現出理想性。理想溶液表現出的特性是不同的。理想溶液組分之間存在的相互作用是相同的。
對於**理想溶液B**,溶解兩種不同的**組分**後,溶液的焓不會發生任何變化。形成理想溶液後,溶解兩種組分後的體積變化為零。拉烏爾定律的理想溶液處理的是混合物的**蒸氣壓**。甲苯和苯的混合物是理想溶液的一個例子,它符合理想溶液的所有標準。
常見問題
1. 舉例說明一些理想溶液?
一些例子是正庚烷和正己烷、氯苯和溴苯、溴乙烷和碘乙烷等
2. 什麼是非理想溶液?
不服從理想溶液任何標準的溶液是非理想溶液。非理想溶液中存在的組分之間的分子間力並不相同。而且,非理想溶液也不遵循拉烏爾定律。
3. 舉例說明一個非理想溶液?
非理想溶液有很多例子,與理想溶液相比,生產非理想溶液並不是一個複雜的過程。非理想溶液的一個例子是丙酮和氯仿的混合物。
4. 什麼是理想氣體?
這是一個假設的概念,其中理想型別的汽體分子沒有任何相互作用,只參與彈性碰撞。它們與真實氣體的性質不同。
5. 什麼是亨利定律?
該定律關注氣體在液體中的溶解。溶解在液體中的氣體的重量與氣體對液體的壓力相似。該定律僅解釋稀溶液和低壓氣體。因此,特定氣體的溶解度與其壓力呈線性關係。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP