理想氣體與真實氣體的區別
引言
理想氣體只是一種理論上的氣體(只存在於理論中),因為實際上不可能存在理想氣體。理想氣體由大量隨機(向任意方向)旋轉的點狀粒子組成,這些粒子之間不相互作用。理想氣體(理論氣體)的概念或思想之所以有用或重要,是因為它完全遵循理想氣體定律(或理想氣體方程)。真實氣體是非理想氣體,其分子佔據一定空間,並相互作用,並且不遵循理想氣體定律或理想氣體方程。在常溫常壓下,冷空氣表現為理想氣體,但隨著氣體壓力和溫度的升高,由於氣體分子之間的相互作用,它開始表現得像真實氣體。
什麼是理想氣體?
理想氣體只不過是一種理論上的氣體,在現實或現實世界中並不存在。它由大量隨機(向任意方向)運動的點狀粒子組成,這些粒子之間不允許相互作用。但是,理想氣體的概念或思想是必不可少的,因為它遵循理想氣體定律:P(壓力,單位為atm或bar)×V(體積,單位為l或mL)= n(給定的摩爾數)×R(氣體常數)×T(溫度)。在某些特殊情況下,例如完全彈性碰撞或點狀碰撞,零相互作用(彼此碰撞)的基本要求通常可以放寬。儘管在各種情況下,例如溫度(T)和壓力(P)的變化,許多真實氣體開始表現得像理想氣體,其中氣體分子充當理想粒子。通常,在較高溫度和較低壓力下,氣體開始表現得像理想氣體,因為由於分子間力(一種分子力)而產生的勢能(U)與具有動能的粒子相比變得非常低或不那麼重要。
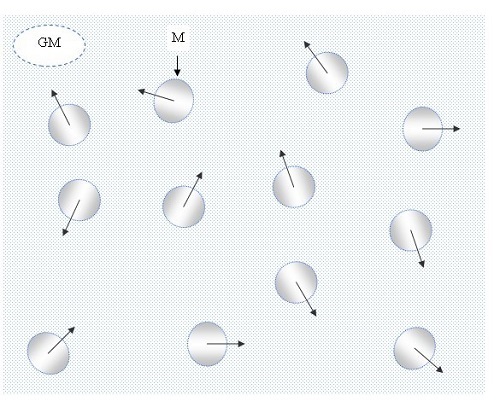
Василь Іванович Сидоров,分子動力學42. 理想氣體模型,CC BY-SA 4.0
理想氣體的性質
理想氣體的一些性質或特徵如下:
理想氣體是可壓縮的,因為分子包含如此多的能量,以至於它們迫使彼此向內移動,這就是我們所說的壓縮。
在理想氣體中,大多數與容器的碰撞都是彈性的,這意味著它們在碰撞後不會損失能量或能量為零,並繼續運動。
理想氣體能夠由於其可壓縮性而佔據其所處的容器的形狀。因此,容器的體積可以被認為是容器記憶體在的氣體的總體積。
理想氣體表現為惰性,這意味著它們被假定不會相互反應。
理想氣體的粒子或分子是點質量,沒有或體積為零。
什麼是真實氣體?
真實氣體是非理想氣體,其分子佔據空間並相互作用。真實氣體不遵循理想氣體定律或理想氣體方程。因此,真實氣體透過考慮它們的摩爾質量或分子量和摩爾體積或分子體積來進一步設計、建模或表示。即$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)\:or\:,p\:=\:\frac{RT}{(V_{m}\:-\:b)}\:=\:\frac{a}{V_{m}^{2}}}$其中p=壓力(單位為atm或bar),T=溫度(大多以開爾文為單位),R=理想氣體常數或氣體常數,𝑉𝑚=摩爾體積。a和b是變化的變數,並根據經驗為各個氣體確定。當我們增加理想氣體的壓力或溫度時,分子之間的相互作用變得非常快或迅速,無法使用氣體定律計算或預測,因此被認為是真實氣體。在這裡,氣體分子彼此之間發生非彈性碰撞。在真實氣體中,分子或粒子之間存在吸引力或排斥力。
Pbsouthwood,真實氣體壓縮圖(潛水呼吸氣體),CC0 1.0
真實氣體的性質
真實氣體的一些性質或特徵如下:
真實氣體具有確定的體積。
在真實氣體中,大多數與容器或彼此之間的碰撞是非彈性碰撞。
在真實氣體中,分子之間存在分子間吸引力或排斥力。
這裡,分子施加在放置它們的容器上的壓力小於理想氣體。
在真實氣體中,氣體分子可以自由地相互作用或碰撞。
真實氣體不遵守理想氣體方程,但它們遵守範德瓦爾斯真實氣體方程,即$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)}$
理想氣體與真實氣體的區別
| 理想氣體 | 真實氣體 |
|---|---|
| 理想氣體沒有確定的體積,因為它佔據其所處容器的形狀。 | 真實氣體佔據確定的體積,因為它不佔據容器的形狀。 |
| 這裡分子之間沒有分子間力(無論是吸引力還是排斥力)。 | 這裡存在分子間吸引力或排斥力。 |
| 這裡的粒子發生彈性碰撞。 | 這裡的粒子發生非彈性碰撞。 |
| 理想氣體是一種理論概念,自然界中不存在。 | 真實氣體在現實中存在。 |
| 這裡的分子以非常高的壓力隨機移動。 | 這裡的分子以比理想氣體低的壓力隨機移動。 |
| 它遵循理想氣體定律,即$\mathrm{PV\:=\:nRT}$。 | 它遵循範德瓦爾斯真實氣體方程,即$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)}$ |
結論
理想氣體只不過是一種理論上的氣體(只存在於理論中),自然界中並不存在。這種氣體遵循理想氣體定律方程,即PV = nRT。在理想氣體中,分子以非常高的壓力向隨機方向移動。這裡存在的粒子發生彈性碰撞,並且不存在分子間力。真實氣體是在自然界中存在的氣體,它們也稱為非理想氣體,因為它們不遵循理想氣體定律或理想氣體方程。在真實氣體中,分子以比理想氣體低的壓力向隨機方向移動,並且這裡的粒子可以相互作用併發生非彈性碰撞。
常見問題
1. 理想氣體是什麼意思?
理想氣體是一種理論上的(非實際的)氣體,它遵循或遵守理想氣體定律,由PV = nRT給出。但在現實中,並不存在這種氣體。它由大量隨機(向任意方向)運動的點狀粒子組成,這些粒子之間不允許相互作用。
2. 什麼是非理想氣體?
真實氣體也稱為非理想氣體,它不遵循理想氣體定律或理想氣體方程。這種氣體存在於自然界中,這裡的分子發生非彈性碰撞,並且分子可以相互作用。
3. 寫出範德瓦爾斯方程?
範德瓦爾斯氣體方程由$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)}$給出,其中p或P=施加的壓力,T=所需的溫度,R=理想氣體常數,𝑉𝑚=摩爾體積(氣體佔據的體積)。a和b是因氣體而異的變數。
4. 什麼是彈性碰撞?
彈性碰撞是一種發生在兩個物體之間的碰撞,其中碰撞前後動能(K.E.)保持不變,或者能量(動能)沒有淨損失。
5. 哪個氣體發生非彈性碰撞?
真實氣體發生非彈性碰撞(碰撞前後動能不保持不變)。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP