氯氣
引言
氯氣是一種綠黃色的氣體,化學式為Cl2。Cl–Cl通常被稱為氯元素形式。它的結構由兩個透過共價鍵連線的氯原子組成。觀察到這兩個原子都具有sp3雜化,這意味著它具有四面體結構。它具有特定的化學結構和分子式,將在下文描述。
什麼是氯氣?
氯氣是一種令人窒息的綠黃色氣體,具有難聞的氣味。它在大約35°C時可以液化,並且在一定程度上可溶於水。這種氣體以壓縮液化氣體的形式出售,具有物理和化學性質。[Ne]103s23p5是這種氣體的電子構型,它也以氯離子的形式存在。
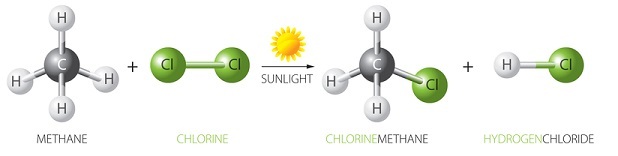
圖1 - 甲烷和氯氣
氯氣含有兩種穩定的同位素,37Cl和35Cl。其中,氯的穩定放射性同位素是36Cl。氯最常見的化合物是氯化鈉。氯化鈉的化學式為NaCl,具有很高的反應活性。如果大量吸入,它對健康有害,會引起皮膚不適和眼睛刺激。它是一種強氧化劑,因此可能引起火災。氯是人體中存在的電解質之一,它可以調節體液、酸鹼度和相關的生理活動。
結構
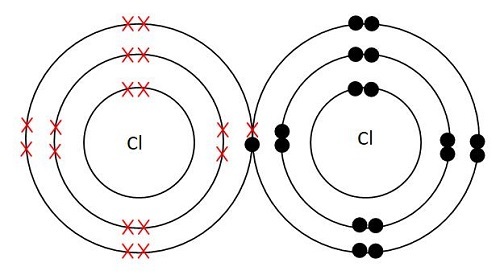
圖2 - 氯氣結構
氯氣的化學式為Cl2,分子量為70 g/mol。氯的元素形式為Cl–Cl,這意味著它的結構由兩個透過共價鍵連線的氯原子組成。這裡,兩個原子都具有sp3雜化,這意味著它們具有四面體結構。
性質
氯氣具有物理和化學性質,這兩種性質表現出不同的特徵。它呈黃綠色,具有類似於家用漂白劑的氣味。它可溶於水,並與水反應生成次氯酸和鹽酸。它以壓縮液化氣體的形式出售,可以在大約35°C時液化。下表可以方便地描述其物理性質:
| 氯氣化學式 | $\mathrm{Cl_{2}}$ |
| 分子量 | 70.906 g/mol |
| 密度 | 3.2 g/L |
| 熔點 | -101.5°C |
| 沸點 | -34.038°C |
表1 - 氯氣的物理性質
這種氣體也具有化學性質,氯氣的化學性質與元素氯相似。它具有氯原子的$\mathrm{[Ne]^{10}3s^{2}3p^{5}}$電子構型。它與有機化合物和氨反應生成有機氯化物或氯胺。這些氯胺屬於具有消毒效能的氯化合物。它也作為廢水中存在的還原劑。這個反應稱為氯需求,其公式為:
$$\mathrm{H_{2}O\:+\:Cl_{2}\:\rightarrow\:HCl\:+\:HClO}$$.
用途
氯氣具有消毒特性,因此它被用於水處理。它也被用作造紙工業中的漂白劑。這種氣體是一種無機氣體,在化學工業中以受控的量使用。關於這種氣體存在爭議,因為它已被用作化學武器。它具有非金屬特性,這就是為什麼這種分子非常活潑且電負性高的原因。它被稱為鹵素,最著名的化合物是氯化鈉(NaCl)。漂白劑用於去除飲用水中的病毒和細菌。其他用途包括製藥、染料、農業和汽車工業。
氯氣毒性
圖3 - 毒死蜱
氯氣被稱為有毒氣體,因為它對人類和自然生命都有害。由於氯氣,水生水體受到了破壞。人類可以檢測到非常低濃度的氯氣。1-3 ppm的氯氣會導致喉嚨、鼻子和眼睛刺激。5-15 ppm會導致中度粘膜刺激,而30 ppm會導致咳嗽、呼吸困難和胸痛。在30分鐘內接觸400 ppm的氯氣也會致命。
結論
氯氣被歸類為肺部刺激劑或窒息劑。它會對人體健康造成各種有害影響,並對組織造成嚴重損害。它可溶於水,其化學式為Cl2。氯氣呈黃綠色,具有刺激性氣味。它屬於鹵素,很容易在自然界中找到。必須小心處理,因為它在低濃度下是有毒的。這種氣體有害影響在於它在歷史上被用作化學武器。
常見問題
1. 氯氣是否非法?
它是一種有毒氣體,但其毒性程度不足以有效地用作化學武器。氯氣的使用並未被禁止,但將其用作武器是被禁止的。
2. 這種氣體的主要用途是什麼?
它主要用作化學武器,並有助於汙水處理消毒。這種氣體有助於控制氣味,並有助於紙漿和造紙廠系統以及工業水冷卻系統。它廣泛用於市政汙水處理和各種工業實踐。
3. 氯氣對人有什麼影響?
氯氣對健康有害,具有腐蝕性和刺激性。它會影響人類的呼吸道、皮膚和眼睛。據觀察,接觸氯氣會導致喉嚨、鼻子和眼睛灼傷。在30分鐘內,430 ppm的氯氣也會致命。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP