氯
介紹
氯是一種化學元素,原子序數為17。它屬於元素週期表中的17族。其化學式為Cl₂,電子構型為$\mathrm{1s^{2}\:2s^{2}2p^{6}3s^{2}3p^{5}\:(or\:[Ne]^{10}3s^{2}3p^{5})}$。這種元素在工業和各種家用工作中都有多種用途。透過加壓可以將其轉化為液態。
什麼是氯?

化學元素Cl₂是鹵素元素中第二輕的成員。它屬於元素週期表中的17族(VIIa族)。它是一種腐蝕性、有毒的黃綠色氣體,會刺激眼睛和呼吸系統。它位於元素週期表中氟和溴之間,在室溫下以氣態存在。其電子構型為$\mathrm{1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}\:(or\:[Ne]^{10}3s^{2}3p^{5})}$。
它是地球上海洋中第三豐富的元素。它具有強烈的氣味,也存在於人體中。它由兩種同位素組成,原子質量分別為35和37。有時它以有毒氣體的形式存在。透過加壓可以將其轉化為液體並儲存。吸入大量氯氣會導致肺水腫。
性質
物理性質
| 顏色 | 黃綠色 |
| 狀態 | 室溫下為氣態 |
| 氣味 | 令人不適的窒息性氣味 |
| 密度 | 3.214g/cm³ |
| 溶解度 | 可溶於水 |
| 沸點 | -34.04°C |
| 熔點 | -101°C |
| 原子序數 | 17 |
| 原子量 | 35.453 g·mol⁻¹ |
| 鮑林電負性 | 3.0 |
| 範德華半徑 | 0.127 nm |
| 離子半徑 | 0.184 (-2) nm; 0.029 nm (+6) |
| 同位素 | 4 |
| 電子層 | $\mathrm{[Ne]3s^{2}3p^{5}}$ |
| 第一電離能 | 1255.7 kj·mol⁻¹ |
| 第二電離能 | 2298 kj·mol⁻¹ |
| 第三電離能 | 3822 kj·mol⁻¹ |
| 標準電極電勢 | -1.36 V |
| 發現者 | 卡爾·威廉·舍勒 (1774年) |
| 毒性 | 劇毒 |
表1——氯的物理性質
化學性質
| 化合物 | 聚氯乙烯、鹽酸和氯化鈉 |
| 與金屬的反應性 | 乾燥的氯對大多數金屬都有反應性,但僅在加熱時才發生反應。 |
| 燃燒 | 在潮溼環境下,與鹼金屬反應會發生燃燒。 |
| 爆炸性 | 某些混合物具有爆炸性。 |
| 氧化 | $\mathrm{Cl_{2}O\:,\:ClO_{2}\:,\:Cl_{2}O_{6}\:,\:Cl_{2}O_{7}\:and\:Cl_{2}O_{8}}$是氯的氧化物。 |
圖2——氯的化學性質
結構
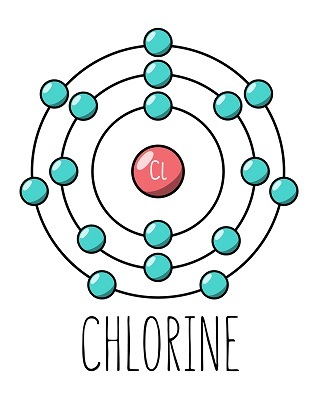
氯的原子序數為17,這意味著Cl₂在其原子結構中含有17個質子和17個電子。存在三個主要的電子殼層,電子排列在這些殼層中。第一個電子殼層包含2個電子,第二個殼層包含8個電子,第三個殼層包含7個電子。這表明氯的化合價為7。最重要的是,氯只需要一個電子就能完成其八隅體構型。這就是為什麼氯的化合價也可以認為是1的原因。
用途
氯有多種用途,被認為是消毒水的主要元素。它是汙水和工業廢物消毒過程的一部分。在造紙和紡織品生產過程中,它用作漂白劑。Cl能夠溶於水,這就是為什麼它被用於家用漂白劑的原因。它也用於藥品的製造過程。
它有助於降低膽固醇,控制關節炎疼痛,緩解過敏症狀。氯有助於提純沙粒中的矽,並將其轉化為太陽能電池板晶片。在安全氣囊、坐墊和保險槓的製造過程中,它被使用。Cl透過保護作物免受病蟲害的侵害,有助於作物的豐收。它還有助於保持廚房表面無菌。氯被用於製造用於智慧手機、筆記型電腦和計算機的高速處理器。
結論
本教程總結道:氯(Cl)是地球海洋中第三豐富的元素。它具有不同的特性,在家用和工業(如造紙業)中有很多用途。它呈黃綠色,氣味非常強烈。氯是由兩種穩定的同位素組成的混合物,例如氯-35和氯-37。Cl也以負離子的形式存在於人體中,稱為氯離子。
常見問題
1. 哪些食物中含有大量的氯?
含有大量氯的食物包括西紅柿、海藻、萵苣、黑麥、橄欖和芹菜。氯化鉀具有常見的鹽基,可用於食品加工。關於氯最重要的一點是,它也以負離子的形式存在於人體中,稱為氯離子。
2. 氯是天然存在的嗎?
據觀察,氯在地球上並不天然存在。關於它最重要的一點是,電解海水可以產生氯。它被認為是人體中第九豐富的元素。
3. 氯有哪些用途?
氯有不同的用途,例如消毒水。它是汙水和工業廢物消毒過程的一部分。它在紡織品和紙張的生產過程中用作漂白劑。許多家務活都是透過漂白完成的,它在清潔產品中也有多種用途。
4. 為什麼氯如此有害?
呼吸過程中過量攝入氯會導致肺部積液。這種情況被稱為肺水腫,據觀察,當一個人接觸壓縮液體時,會導致皮膚和眼睛凍傷。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統 (RDBMS)
關係型資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP