三氟化氯
介紹
三氟化氯 (ClF3) 具有高度的可燃性和爆炸性。在第二次世界大戰期間,納粹對 ClF3 感興趣,試圖將其用於製造強大的炸彈。然而,由於其易揮發和反應性強烈的特性,其生產被減少了。這就是為什麼戰後它從未被用於戰鬥的主要原因。由於其破壞性,三氟化氯在《化學武器公約》中被禁止,其生產量甚至限制在 30 噸以內。
什麼是三氟化氯?
在 20 世紀 30 年代,兩位科學家奧托·魯夫 (Otto Ruff) 和 H. 克魯格 (H. Krug) 發現了一種比氟更具反應性的液態化合物,他們分離出了三氟化氯 (ClF3)。它可以定義為一種由化學式 ClF3 表示的互鹵化物化合物。它也稱為氯氟化物和三氟-λ3-氯烷。這種氣體如果有人靠近會造成肺損傷。除此之外,它還會刺激皮膚、眼睛和粘膜。ClF3 被認為是最強的氧化劑之一,它與任何易燃物質接觸都會著火。
三氟化氯的結構

圖 1 - 三氟化氯
三氟化氯,公共領域,來自維基共享資源
就分子幾何而言,ClF3 具有兩個長鍵和一個短鍵,由於這些鍵,它呈現T字型形狀。在 ClF3 分子中,氯原子位於中心。它有五個區域電子密度:三個鍵和兩個孤對電子。ClF3 的結構遵循 VSEPR 理論,因為存在於兩個赤道位置的孤對電子呈三角雙錐形排列。它們的 F-Cl-F 鍵角為 175 度。由於超價鍵合,Cl-F 鍵是穩定的。在石英容器中,ClF3 在 180°C 以下被認為是穩定的,高於此溫度,它會分解成其組成元素,這是由於自由基機制造成的。
三氟化氯的性質
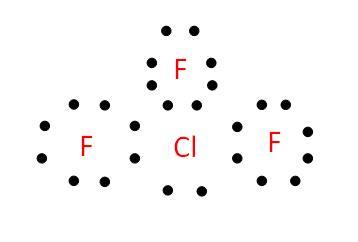
圖 2 - 三氟化氯的電子結構
ClF3 是一種在自然界中找不到遊離狀態的化合物。作為一種化合物,它不僅危險,而且高度易燃。它的密度為 **1.77g/cm3**,摩爾質量為 **92.448g/mol**。ClF3 的沸點和熔點分別為 **11.75°C** 和 **-76.34°C**。在 ClF3 的結構中,存在 4 個原子,它也具有一個共價鍵合單元,此外,它可以溶於水。氣態或蒸汽狀態的 ClF3 可以分解成 ClF、ClOF、ClO2F、ClO3F、Cl2 和 HF。最後三個是最重要的。然而,結果總是取決於水的可用性。
三氟化氯的製備
ClF3 可以透過氯氣和氟氣直接反應制備。該反應可表示為:
$$ \mathrm{Cl_{2}\:+\:3F_{2}\:\rightarrow\:2ClF_{3}} $$
另一方面,它可以透過 ClF 和氯氣之間的反應制備。它可以用方程式表示,即:
$$ \mathrm{ClF\:+\:F_{2}\:\rightarrow\:ClF_{3}} $$
三氟化氯的用途
ClF3 可用作氟化劑。
它可用作火箭的點火劑和推進劑。
ClF3 被認為是製造核燃料的最重要組成部分。
它在氟碳聚合物的熱解抑制劑中起著重要作用。
它用於將鈾轉化為氣態六氟化鈾。
它用於清潔半導體工業中的化學氣相沉積。
ClF3 與磷反應生成 PCl3(三氯化磷)和 PF5(五氟化磷)。
關於三氟化氯的事實
ClF3 有許多重要的方面。如果 ClF3 與任何元素接觸,它會經歷蒸發過程並轉化為有毒氣體。對於實驗室實驗,如果 400 ppm 的 ClF3 暴露 30 分鐘,會造成老鼠死亡。除此之外,ClF3 共有 28 個價電子,鍵存在於 Cl 原子與其周圍的氟原子之間。此外,在分解過程中,ClF3 會產生以蒸汽形式存在的氫氟酸和鹽酸。
結論
ClF3 是最危險的化合物之一,由於其易燃性而被認為是危險的。它甚至可以點燃一些最不易燃的物質,例如沙子、玻璃甚至石棉。最危險的部分是它可以與燃燒後的元素如灰燼發生燃燒反應。然而,由於其多用途,它仍然被認為是有用的。
常見問題
1. 三氟化氯的主要用途是什麼?
三氟化氯的主要用途是作為火箭燃料,也可用於核反應堆燃料的加工。
2. 三氟化氯易燃的根本原因是什麼?
三氟化氯易燃的原因在於其氧化性。它的氧化性比氧氣本身更強。它不僅易燃,而且由於其氧化性而被認為是一種極其有效的爆炸物。
3. 三氟化氯的常用名稱是什麼?
三氟化氯也稱為氯氟化物,表示為 ClF3。
4. 三氟化氯是如何形成的?
三氟化氯是由中間的氯陽離子和與之結合的三個氟陰離子形成的。
5. 三氟化氯的顏色是什麼?
三氟化氯的氣態形式呈無色,而液態形式呈綠色,並具有刺鼻的氣味。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP