休克爾規則
簡介
德國化學家和物理學家埃裡希·休克爾於1931年確定了休克爾規則。他提出芳香環遵循四個準則才能成為芳香族化合物。第一個是它應該是環狀的,第二個是它應該是平面的,第三個是它應該具有共軛結構,第四個是它必須遵循休克爾規則。芳香族化合物具有$\mathrm{4n\:+\:2\:pi\:electrons}$。公式中的n是一個正整數。芳香族化合物具有$\mathrm{sp^{2}\:hybrodization}$。
什麼是休克爾規則?
休克爾規則是一種演算法,它結合了芳香環中π電子的數量,並確定環是芳香族還是非芳香族。它由公式4n+2定義。如果得到的N值為整數,則符合條件。除此之外,化合物必須滿足以下標準才能成為芳香族化合物。
芳香族化合物必須是環狀的。
該化合物應該是平面型的,這意味著它具有$\mathrm{sp^{2}}$雜化。
該化合物具有共軛結構,意味著π電子可以在整個環上發生共振,使其具有共軛性。
第四,它必須遵循休克爾的芳香性規則。
| 芳香族化合物 | 休克爾規則 (4𝑛 + 2) |
| 非芳香族化合物 | 莫比烏斯體系 (𝟒𝒏) |
對芳香族化合物的貢獻
並非所有環狀、平面和共軛的化合物都穩定且芳香。化合物中的芳香性使其更加穩定。我們可以透過環丁二烯和苯環的例子來更好地理解這一點。
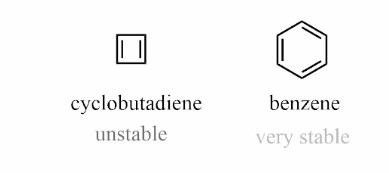
在環丁二烯中,它是環狀的、平面的和共軛的,但由於不遵循休克爾規則而不穩定。在環丁二烯中,它總共有4個π電子。
$$\mathrm{4n\:+\:2\:=\:=\:4}$$
$$\mathrm{4n\:=\:4\:-\:2}$$
$$\mathrm{n\:=\:\frac{2}{4}}$$
$\mathrm{n\:=\:\frac{1}{2}}$ 它是一個分數值,
因此,它不遵循休克爾規則,並且高度不穩定,它是反芳香族的。
在苯環中,它是環狀的、平面的、共軛的,讓我們檢查它是否遵循休克爾規則。它有6個π電子。
$$\mathrm{4n\:+\:2\:=\:6}$$
$$\mathrm{4n\:=\:6\:-\:2}$$
$$\mathrm{4n\:=\:4}$$
$$\mathrm{n\:=\:\frac{4}{4}}$$
n=1,n的值是整數,這意味著它遵循休克爾規則並且是穩定的化合物。
為什麼是4n+2個電子?
根據休克爾的軌道理論,當軌道中存在的電子配對時,化合物是穩定的。芳香族化合物比反芳香族或非芳香族化合物更穩定。芳香族化合物遵循休克爾規則,並且在它們的軌道中具有4n個π電子。
在苯中,有6個π電子,具有sp2雜化。s軌道中的前兩個電子處於最低能級,其餘4個π電子處於p軌道中。它們處於更高的能級。
所有電子都位於成鍵軌道中,沒有一個位於反鍵軌道中。
休克爾規則在苯環中的應用。

$$\mathrm{4n\:+\:2\:=\:6}$$
$$\mathrm{4n\:=\:6\:-\:2}$$
$$\mathrm{4n\:=\:4}$$
$$\mathrm{n\:=\:\frac{4}{4}}$$
$$\mathrm{n\:=\:1}$$
1是一個整數,遵循休克爾規則。
如果一個化合物具有奇數個電子對,即(1、3、5、7、9、11…等),我們也可以判斷該化合物是否為芳香族。
如果一個化合物在軌道中具有2、6、10、14和18個電子,則它遵循休克爾規則。
休克爾規則的一些例子
萘中的芳香性

萘分子
在萘分子中,電子數為10個π電子。它是環狀的、平面的和共軛的。我們必須透過4n+2公式進行檢查。
$$\mathrm{4n\:+\:2\:=\:10}$$
$$\mathrm{4n\:=\:10\:-\:2}$$
$$\mathrm{4n\:=\:8}$$
$$\mathrm{n\:=\:\frac{8}{4}}$$
$$\mathrm{n\:=\:2}$$
n的值為2,這是一個整數,這意味著萘遵循休克爾規則並且是芳香族的。
戊烯中的芳香性

戊烯
也是一種環狀化合物,平面且具有sp2雜化的共軛結構,並且具有8個π電子。
$$\mathrm{4n\:+\:2\:=\:8}$$
$$\mathrm{4n\:=\:8\:-\:2}$$
$$\mathrm{4n\:=\:6}$$
$$\mathrm{n\:=\:\frac{6}{4}}$$
$$\mathrm{n\:=\:\frac{3}{2}}$$
我們已經計算了該值,發現n的值為3/2,這是一個分數。即使它滿足芳香性的所有其他標準,但它不遵循休克爾規則。因此,它不是芳香族的。
休克爾規則的應用
休克爾規則幫助我們找到單環烴化合物的穩定性。在環戊二烯負離子𝐶5𝐻5−中,它有6個π電子,並且遵循休克爾規則。因此,它是一種穩定的化合物。
它幫助我們透過𝑡ℎ𝑒 $\mathrm{4n\:+\:2}$規則來定義化合物是芳香族還是非芳香族。
一些化合物的陽離子和陰離子遵循休克爾規則。它們可以表現出不同的穩定性。吡咯就是一個這樣的例子,它有4個電子和一對孤對電子,它們有助於π鍵的形成。我們得到6個π電子,它們遵循休克爾規則。因此,吡咯是一種芳香族化合物。

在環戊二烯負離子中,有6個π電子。4個電子來自兩個π鍵,一對來自陰離子。π電子的總數為6,遵循休克爾規則。因此,它是一種芳香族化合物。

休克爾規則的例外
休克爾規則有一些例外。
平面化合物不是很穩定,但環丁二烯𝐶4𝐻4是一種平面、環狀和非芳香族化合物,但在低於35開爾文溫度下是穩定的。
另一個例外是多環化合物芘,它是一種芳香族化合物,但不遵循休克爾規則。

芘
還有一個例外是反式雙環戊二烯,它是一種具有8個π電子的芳香族環狀化合物,但不遵循休克爾規則。

反式雙環戊二烯
結論
在本教程中,我們學習了休克爾規則,它幫助我們找出化合物是芳香族還是非芳香族。遵循四個標準的環狀化合物,即它是平面的,具有$\mathrm{sp^{2}}$雜化,並且其電子在整個環中發生共振,它是環狀的並且遵循休克爾規則4𝑛 + 2,是一種芳香族化合物,但也有一些例外,如芘、反式雙環戊二烯,它們是芳香族但並不遵循休克爾規則。它幫助我們找出化合物的穩定性。
常見問題
1. 什麼是反芳香族化合物?
它遵循4n莫比烏斯體系。它們是環狀的、平面的和共軛的,但高度不穩定。例如:環丁二烯,它具有4個π電子。
2. 解釋為什麼環戊二烯負離子是芳香族化合物?
環戊二烯負離子是一種環狀、平面化合物,具有孤對電子,碳的負電荷形成$\mathrm{sp^{3}}$雜化,為了穩定芳香環,它轉變為$\mathrm{sp^{2}}$雜化,並且孤對電子在環上離域。
3. 為什麼環丙烯基陽離子是芳香族的?
環丙烯基陽離子是一種環狀化合物,並且具有$\mathrm{sp^{2}}$雜化。它具有三個碳原子和2個π電子。環丙烯基的陽離子具有平行和平面的p軌道,並滿足芳香族化合物的所有標準。
4. 什麼是芳香族化合物?
芳香族化合物是具有σ鍵和環碳之間離域π電子的烴。
5. 芳香族化合物的用途是什麼?
芳香族化合物高度穩定,用於藥物、殺蟲劑、燃料形成、油漆、洗滌劑等。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP