一級反應
引言
反應進行的速度被稱為反應速率。反應速率可以根據反應物的濃度來確定。反應速率與產物的生成速率成正比,也與反應物濃度的減少成反比。許多化學反應進行得很快。例如,纖維素上的燃燒反應是一個在幾秒鐘內發生的快速反應。而一些化學反應則比較慢。例如,鐵的生鏽是一個非常緩慢的過程,需要很長時間才能發生。透過確定濃度的變化,可以很容易地找到反應速率。
什麼是反應級數?
反應速率與反應物濃度之間的關係就是反應級數。反應級數可以從速率方程中區分出來,因為它是濃度值中指數的總和。因此,反應級數是反應物物種所升高的指數,它取決於該特定反應的速率。級數是從速率定律中得到的。例如,在一個反應中,
$$\mathrm{aA+bB\longrightarrow P}$$
速率方程為:
$$\mathrm{rate=k[A]^x [B]^y}$$
從方程中,反應物 A 的級數為 x,來自 A 的濃度 [A]。對於反應物 B,方程中的級數為 y,來自 B 的濃度 [B]。而項 K 是速率係數或速率常數。因此,該反應的淨級數可以透過將這兩個級數加在一起計算出來。所以,n=x+y 是特定反應的級數。
特徵
反應級數有一些特徵。反應級數並不總是整數。即使從方程式中,我們也瞭解到它確實依賴於反應物的濃度來形成產物。但它並不總是遵循這個特徵。這意味著有些反應甚至不依賴於反應中存在的反應物濃度。因此,基於此,反應級數有一些特徵。反應級數也可以為零,即零級反應,其中反應速率與反應中涉及的化學物質的濃度無關。
還需要知道反應速率也可能受到反應物濃度的負面影響。也就是說,反應速率與反應物濃度成反比。因此,在這種情況下,級數變為負值。
而且反應級數可以是正值,其中速率直接取決於濃度。反應物濃度的增加會增加反應速率。
還有一些情況下,反應速率可以是非整數,這意味著它不會是正值或負值。非整數存在於一些複雜的反應中。
如何找到反應級數?
對於每一個化學反應,反應速率的概念都非常重要。反應級數涉及反應物如何影響特定反應速率的概念。通過了解反應級數,我們可以更加關注將影響化學反應速率的反應物。因此,它不會僅僅透過檢視化學方程式就能獲得。它需要另一種方法來找到反應級數。
以下方法可用於確定反應級數:
反應級數可以透過以下方法輕鬆獲得。
從速率方程 - 透過使用化學反應的速率方程,我們可以找出反應級數。例如,以下速率的級數為:
速率 = k[A]2,級數為二。
透過使反應物加倍 - 使化學方程式中存在的反應物濃度加倍並觀察其影響有助於找出反應級數。實驗方法始終用於確定級數。
微分法 - 該方法也稱為初始速率法。因為它涉及透過改變其中一個反應物濃度來確定反應速率,而其餘反應物保持不變。
圖解法 - 在這種方法中,確定只涉及一個反應物的化學反應的方法。如果 A 是所涉及的反應物,繪製一個圖,其中 logA 與時間的關係提供一條直線,則它將是一級反應。而 1/A 與時間的關係圖是一條直線,則它將是二級反應。
積分法 - 使用速率定律的積分形式來確定反應級數。
反應分子數與反應級數的區別
反應分子數和反應級數是處理化學反應的兩個重要術語。這兩個術語之間的區別如下表所示。
| 反應分子數 | 反應級數 |
|---|---|
| 它涉及速率決定步驟,其中參與的分子數。 | 反應速率和反應物的濃度與反應級數有關。 |
| 該值始終為整數,不能為負。 | 化學反應級數的值可以為零、整數、非整數、負數等。 |
| 從反應機理中,可以很容易地獲得反應分子數的值。 | 需要採用多種方法以及一些實驗和方法來確定級數。 |
| 反應分子數的值不會隨任何外部環境(如溫度和壓力)而變化。 | 級數依賴於諸如溫度和壓力等事實環境。 |
零級反應
零級反應或零級反應是不依賴於反應中涉及的化學物質濃度的化學反應。速率方程中反應物的指數為零。
$$\mathrm{Rate=K[reactant]^0=K}$$
對於此類反應,繪製濃度與時間的曲線圖。曲線圖是:
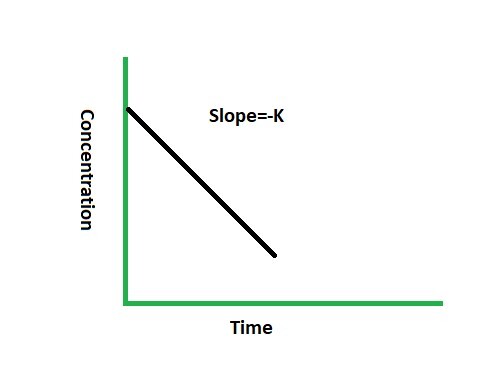
一個涉及零級反應的反應示例是 N2 O(一氧化二氮)在 200°C 至 400°C 的溫度下分解。反應為:
$$\mathrm{2N_2 O(g)+ Pt\rightarrow 2N_2 (g)+O_2 (g)}$$
一級反應
反應速率僅取決於其中一種反應物的反應稱為一級反應。對於此類反應,如果反應物濃度加倍,則反應速率也會加倍。順鉑(用於治療癌症的藥物)的水解是一級反應的一個例子。此類反應的曲線圖是:
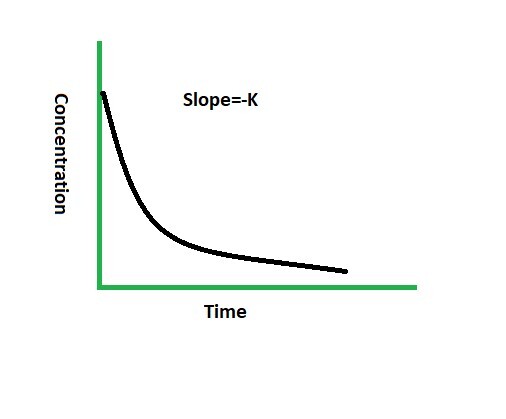
此類反應的速率方程為:
$$\mathrm{rate=k[A]}$$
二級反應
反應速率依賴於反應物濃度平方的反應稱為二級反應。對於反應:
$$\mathrm{2 A \rightarrow products}$$
反應的速率方程將為:
$$\mathrm{rate = k[A]^2}$$
此類反應的一個例子是二氧化氮的分解:
$$\mathrm{2 NO_2 \rightarrow 2 NO + O_2}$$
此類反應的曲線圖將是:
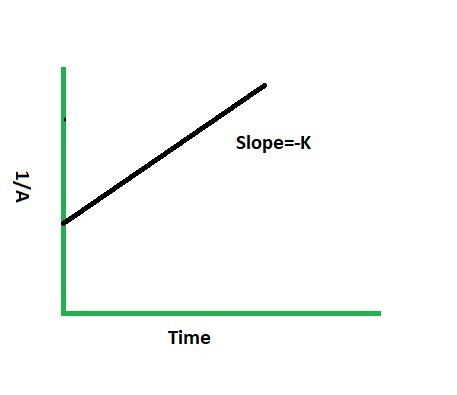
偽一級反應
它們是二級反應,但它們的性質類似於一級反應。此類化學反應的速率取決於兩種反應物,但另一種反應物濃度的變化非常大,甚至無法確定其外觀。乙酸乙酯的水解是偽一級反應的一個例子。
$$\mathrm{CH_3 COOC_2 H_5 + H_2 O \rightarrow CH_3 COOH + C_2 H_5 OH}$$
結論
反應級數與化學方程式的速率有關。速率的知識對於化學反應的進行非常重要。化學反應的級數是濃度值中指數的總和。反應級數具有一定的特徵,可以是負值、非整數和正值。它們根據反應級數分為不同的型別;它們是零級、一級、二級、偽級等。可以採用多種方法來確定反應級數。反應分子數也是一個與反應級數類似的術語,與化學反應有關。但它們是完全不同的術語。
常見問題
1. 給出一個三級反應的例子?
反應 Fe + Br2 → FeBr2 是三級反應的一個例子。
2. 什麼是反應的半衰期?
反應物初始濃度減少一半所需的時間是反應的半衰期。
3. 一級反應的速率常數單位是什麼?
s-1是一級反應速率常數的單位。
4. 二級反應的速率常數單位是什麼?
mol-1 s-1是二級反應速率常數的單位。
5. n級反應的速率常數單位是什麼?
(molL-1 )1-n s-1是n級反應速率常數的單位。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP