置換反應
簡介
被稱為置換反應的化學反應發生在高反應性元素從分子中取代低反應性元素時。置換反應涉及金屬和非金屬。
如果某種化學物質容易且快速地參與化學反應,則稱其具有反應性。不同的金屬具有不同的反應活性。金屬的反應活性可以按等級排列。例如反應序列。反應性較低的金屬要麼參與化學反應的速度非常慢,要麼通常不參與。金屬以及某些其他金屬的複雜性都可以發生置換反應。在置換反應中,更活潑的元素將在其配合物中取代較弱的活潑元素。反應對較弱的活潑金屬沒有影響。它不再與任何其他元素髮生化學結合。現在元素是純淨的。
置換反應定義
置換反應是指一個反應物的一部分被另一個反應物取代的反應。它也被稱為取代反應。因為另一個反應物離子取代了先前存在的離子。
什麼是單置換反應?
單置換反應是指一種元素從其鹽或配合物中置換另一種元素的反應。也稱為單取代反應。也可以寫出一般表示式 -
$$\mathrm{A\:+\:B\:-\:C\:\rightarrow\:A\:-\:C\:+\:B}$$
如果A比B更易反應,它將取代B。例如,鉀取代氯化鎂中的𝑀𝑔,因為它比鎂更具反應活性。
什麼是反應序列?
反應序列是一組按反應活性從高到低排列的金屬。因此,“金屬反應序列”一詞指的是一組按反應活性升序排列的金屬。它也被稱為“活性序列”。金屬的反應活性是由它們的電子結構或它們的外層軌道的未完成性引起的。由於它們傾向於失去電子,因此金屬會產生帶正電的離子。由於它們的電子位於遠離帶正電的原子核的位置,因此原子序數高的金屬往往具有很高的反應活性。因此,它們很容易去除。
化學反應型別
合成反應
當 2 個不同的原子/分子結合形成新的化學物質或分子時,這被稱為合成反應。
$$\mathrm{O_{2}\:+\:2H_{2}\:\rightarrow\:H_{2}O}$$
分解反應
這些反應的 2 個主要類別如下
熱分解反應
它是由熱能觸發的分解反應
例如
$$\mathrm{CaCO_{3}\:\rightarrow\:CO_{2}\:+\:CaO}$$
碳酸鈣在加熱時分解成氧化鈣和二氧化碳。生石灰是許多行業中的一種重要成分,它是透過此過程製成的。
電解分解反應
電解分解過程中,使用電能提供分解的活化能。例如水電解的電解分解反應,其化學方程式為−
例如
$$\mathrm{H_{2}O\:\rightarrow\:2H_{2}\:+\:O_{2}}$$
光分解
在光分解反應中,分析物吸收光子的能量並分解成其組成元素。以下化學方程式表示將分子氧分解成氧自由基的光分解過程。
例如。
$$\mathrm{O_{3}\:+\:hv\:\rightarrow\:O_{2}\:+\:O}$$
置換反應
當分子中的一個元素被另一個元素取代時,該過程稱為置換反應。
單置換反應
當分子中的一個元素被另一個元素取代時,該過程稱為單置換反應。
例如。
$$\mathrm{2K\:+\:2H_{2}O\:\rightarrow\:2KOH\:+\:H}$$
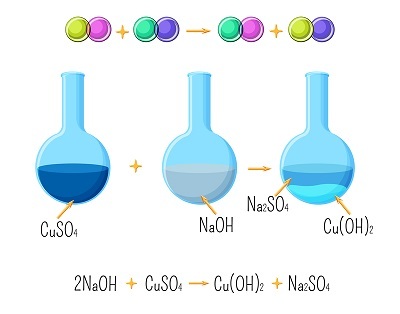
複分解反應
當兩個離子化合物的成分交換時,會產生兩個新的化合物。複分解反應也稱為複分解、交換或複分解反應。
例如。
$$\mathrm{Na_{2}SO_{4}\:+\:BaCL_{2}\:\rightarrow\:BaSO_{4}\:+\:2NaCl}$$
燃燒反應
在燃燒反應中,分子與氧化劑發生反應,這是一種化學過程,會產生熱量以及新的產物。
例如。
$$\mathrm{CH_{4}\:+\:O_{2}\:\rightarrow\:CO_{2}\:+\:H_{2}O}$$
置換反應的用途
鋁 (𝐴𝑙) 和氧化鐵結合形成用於焊接鐵路接頭的合金 $\mathrm{Fe_{2}O_{3}}$。
反應−
$$\mathrm{2AL\:+\:Fe_{2}O_{3}\:\rightarrow\:2Fe\:+\:AL_{2}O_{3}}$$
Fe 可以透過與 𝐶 反應從其礦石中提取。
金屬的提取
酸的中和
$$\mathrm{3C\:+\:Fe_{2}O_{3}\:\rightarrow\:4Fe\:+\:3CO_{2}}$$
可以透過置換過程獲得其他金屬,包括 𝐶𝑟。
$$\mathrm{3C\:+\:Cr_{2}O_{3}\:\rightarrow\:4Cr\:+\:3CO_{2}}$$
我們胃中形成的𝐻𝐶𝑙酸是導致消化不良的原因。抗酸劑的鹼會誘導身體透過自身置換來做出反應。
$$\mathrm{Mg(OH)_{2}\:+\:2HCl\:\rightarrow\:MgCl_{2}\:+\:2H_{2}O}$$
單置換反應的例子
$\mathrm{HCl}$ 和 $\mathrm{Zn}$ 之間的反應−
$$\mathrm{2HCl\:+\:Zn\:\longrightarrow\:ZnCl_{2}\:+\:H_{2}}$$
$\mathrm{Cal_{2}}$ 和 $\mathrm{Cl}$ 之間的反應−
$$\mathrm{CaCl_{2}\:+\:Cl_{2}\:\longrightarrow\:CaCl_{2}\:+\:l_{2}}$$
複分解反應的例子
$\mathrm{AgNO_{3}}$ 和 $\mathrm{NaCl}$ 之間的反應−
$\mathrm{H_{2}SO_{4}}$ 和 $\mathrm{LiOH}$ 之間的反應−
$\mathrm{[Pb(NO]_{3})_{2}}$ 和 $\mathrm{NaCl}$ 之間的反應−
$\mathrm{[Al(SO]_{4})_{3}}$ 和 $\mathrm{NH_{4}OH}$ 之間的反應−
$$\mathrm{NaCl\:+\:AgNO_{3}\:\rightarrow\:AgCl\:+\:NaNO_{3}}$$
$$\mathrm{H_{2}SO_{4}\:+\:2LiOH\:\Longleftrightarrow\:LiO_{2}OH\:+\:2H_{2}O}$$
$$\mathrm{[Pb(NO]_{3})_{2}\:+\:2NaCl\:\Longleftrightarrow\:2NaNO_{3}\:+\:PbCl}$$
$$\mathrm{[Al(SO]_{4})_{3}\:+\:6NH_{4}OH\:\rightarrow\:2AL(OH)_{3}\:+\:3[(NH]_{4})_{2}SO_{4}}$$
置換反應的應用
許多不同的學科都使用了置換反應。以下是一些−
鋁熱焊接使用這些反應,其中鐵被鋁從其氧化物中置換出來。
鋼的製造使用這些反應,其中鐵被碳從其氧化物中置換出來。
大多數情況下,這些反應用於金屬的提取。
這些反應用於治療酸性消化不良。
這些反應用於火焰光度法。
結論
可以得出結論,當一個反應物被另一個反應物部分取代時,該反應稱為置換反應。置換反應也稱為取代反應或複分解反應。置換反應有兩種不同的形式:複分解反應和單置換反應。在複分解反應中,反應物中的陽離子和陰離子交換配偶以產生產物:單置換反應發生在一個反應物部分取代另一個反應物時。
常見問題
1. 置換反應的一般規則是什麼?
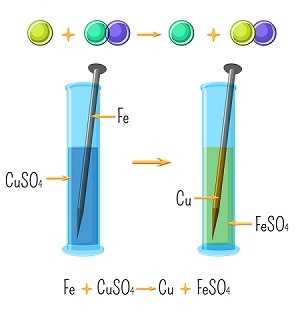
在置換反應中,化合物中的一個成分取代了另一種元素。更活潑的元素通常會取代其化合物中反應活性較低的元素。例如,銅的反應活性低於鐵。當將一塊鐵放入硫酸銅溶液中時,會形成硫酸亞鐵。
$$\mathrm{Fe\:+\:CuSO_{4}\:\rightarrow\:FeSO_{4}\:+\:Cu}$$
2. 為什麼金屬會相互取代?
當電化學系列中較高位置的金屬的離子與靠近底部位置的金屬的離子結合時,就會發生置換反應。
反應性較低的金屬中的離子會獲得從反應性較高的金屬的原子中強迫出來的電子。
3. 什麼導致放熱置換反應?
當分子中的一個元素被另一個元素取代時,就會發生單置換反應。化學反應要麼釋放能量,要麼吸收能量。如果在過程中釋放能量,則它是放熱的。鍵的形成是一個放熱過程。
4. 所有置換過程都包括氧化還原嗎?
是的,所有置換反應都是氧化還原反應。考慮鈉和水之間的相互作用。在這個反應中,鈉從水中去除氫,同時透過接收氧氣而被氧化,並透過去除氧氣將水還原成氫。
$$\mathrm{2Na\:+\:2H_{2}O\:\rightarrow\:2NaOH\:+\:H_{2}}$$
5. 氧化會導致複分解反應嗎?
不。複分解反應中只發生置換。在氧化還原反應中,整個反應過程中被氧化的原子的數量會發生變化。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP