電負性圖表
引言
電負性可以描述為原子(在分子內部)在鍵形成時吸引(力)電子(共享電子)的能力。原子的電負性會受到其原子序數 (Z) 以及價電子與帶電原子核之間的距離的影響(變化)。電負性可用於估計鍵能。可以透過一些標度(如穆利肯標度、鮑林標度和艾裡德-羅肖標度)來確定元素的電負性。
鮑林標度用於查詢任意兩個元素之間的電負性差。而艾裡德-羅肖標度則用於查詢原子的電負性。電負性圖表或表格顯示週期表(p.t)右上方 (r-t) 的元素電負性更高或最高(最大),而底部元素的電負性較低。因此,氟是電負性最高(最大)的元素,銫是電負性最低(最小)的元素。
電負性簡介
電負性可以用符號 (ꭙ) 表示。它被定義或描述為原子在鍵形成(化學鍵)時吸引(共享)電子向自身的能力。電負性可用於估計鍵能 (B.E.) 以及鍵的化學極性符號(‘+’ 或 ‘-’)和大小(數值)。電負性可以透過一些因素來估計,例如核電荷(實際正電荷)、原子殼層中存在的電子數量(no.)、殼層(原子)內部存在的其他電子的位置。
電負性不是任何單個原子的特定性質,而是分子內原子的性質。因此,分子中原子的電負性與第一電離能(強相關)相關,與電子親和力(負相關)相關。然後,出現了一個稱為“基團電負性”或“取代基電負性”的術語。並且該因素也負責影響分子中原子的電負性。
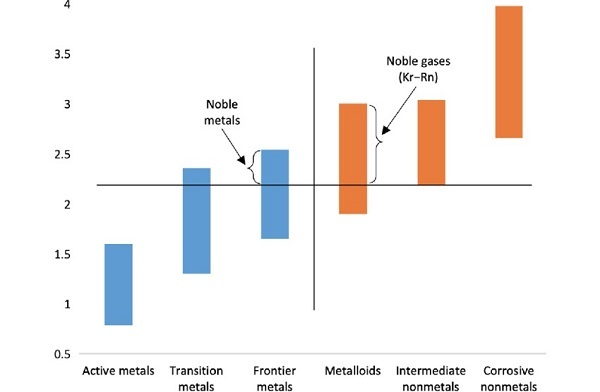
Sandbh,電負性條形圖,CC BY-SA 4.0
什麼是電負性?
電負性可以用符號 (ꭙ) 表示。它被定義或描述為原子在鍵形成(化學鍵)時吸引(共享)電子向自身的能力。電負性可以透過一些因素來估計,例如核電荷(實際正電荷)、原子殼層中存在的其他電子數量(no.)以及殼層(原子)內部存在的其他電子的位置。電負性可用於估計鍵能 (B.E.) 以及鍵的極性(化學)符號(‘+’ 或 ‘-’)和大小(數值)。電負性不是任何單個原子的特定性質,而是分子內原子的性質。因此,分子中原子的電負性與第一電離能 (I.E.)(強相關)相關,與電子親和力(負相關)相關。分子中原子的電負性也會受到基團電負性或取代基電負性的影響。
影響原子(元素)電負性的因素
有兩個因素會影響(改變)原子(元素)的電負性 (ꭙ) -
原子序數 - 原子(在分子內部)的電負性 (ꭙ) 與原子核中質子的數量 (no.) 成正比 (∝)。因此,如果原子核內質子的數量增加,電負性也會增加,反之亦然。
價電子與原子核之間的距離 - 價電子與原子核之間的距離越大,或者我們可以說原子尺寸越大,電負性的值越小,反之亦然。
元素電負性的確定
有不同型別的標度用於計算元素的電負性。
鮑林標度 - 鮑林標度完全基於鍵能與鍵合原子電負性之間的經驗關係。其公式如下: $$\mathrm{ E_{A-B}>\sqrt{E_{A-A}×E_{B-B}}}$$
穆利肯標度 - 穆利肯標度將電離勢和電子親和力的平均值稱為電負性。這可以用以下公式表示:-
$$\mathrm{\frac{Ionization potential+electron affinity}{2}}$$
艾裡德-羅肖標度 - 該標度用於確定有效核電荷對價電子施加的力(靜電力)的值。這種力發生在原子的表面。
電負性圖表和週期表中的電負性趨勢
電負性圖表或表格 - 如我們所知,電負性是原子(單個)吸引原子或原子團共享電子對的能力。週期表(p.t)左側和右側的原子之間存在巨大的電負性差異。電負性在確定元素之間鍵的型別方面也非常重要或有用,並且也被認為是化學鍵閤中的重要因素之一。並且,正如我們所知,當我們在週期表(p.t)中向右 (r) 移動時,原子的電負性會增加,當我們在週期表中向上移動時,其電負性也會增加。因此,週期表右上方 (t-r) 的原子具有最高的電負性,而表格左下方 (b-l) 的原子具有最低的電負性。
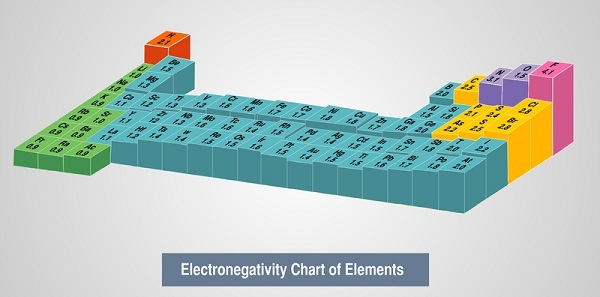
週期表中的電負性趨勢 - 通常,電負性沿族向下減小,沿週期從左 (l) 到右 (r) 增大。因此,發現氟 (F) 在週期表中具有最高(最大)的電負性,而銫在同一週期表中具有最低或最小的電負性。因此,稱為氟化銫的化合物具有最高(最大)的離子性。儘管存在某些例外,例如鎵 (Ga) 和鍺 (Ge)。因為它們分別比鋁 (Al) 和矽 (Si) 具有更高(更多)的電負性。這是由於 d 區塊或 d 軌道收縮。此外,過渡金屬第一行之後的第四 (4th) 週期的元素具有異常小的原子半徑,這再次是由於 d 軌道收縮。這意味著此處 3d 電子 (e^-) 在遮蔽或覆蓋增加的(超過的)核電荷方面無效或無能為力,並且眾所周知,尺寸越小,電負性越高。另一個異常是鉛 (Pb) 與鉈 (Th) 和鉍 (Bi) 相比具有較高的電負性。

過渡金屬中的電負性趨勢
過渡金屬是週期表中 3(三)到 12(十二)族中的元素,並且通常由部分(半)填充的 d 亞層識別。過渡元素的電負性從左 (l) 到右 (r) 以及從上 (t) 到下 (b) 在 d 區塊中增加。儘管由於外層 d 軌道電子的自由流動,過渡金屬具有較低的電負性。
結論
電負性可以用符號 (ꭙ) 表示。它被定義或描述為原子在鍵形成(化學鍵)時吸引(共享)電子向自身的能力。電負性可以透過一些因素來估計或計算,例如核電荷(實際正電荷)、原子殼層中存在的其他電子數量以及殼層(原子)內部存在的其他電子的位置。電負性可用於估計鍵能 (B.E.) 以及鍵的化學極性符號(‘+’ 或 ‘-’)和大小(數值)。電負性不是任何單個原子的特定性質,而是分子內原子的性質。原子的電負性會受到其原子序數 (Z) 和價電子與帶電原子核之間的距離 (d) 的影響(變化)。
常見問題解答
1. 電負性是什麼意思?
電負性定義為分子內原子在鍵形成時吸引共享電子向自身的能力。
2. 什麼是電負性圖表?
電負性圖表是根據元素的電負性值在表格中表示元素。通常,當我們沿週期從左 (l) 到右 (r) 移動時,電負性會增加,而當我們從上 (t) 到下 (b) 或向下(下方)移動一個族時,電負性會降低。
3. 誰開發了電負性圖表?
萊納斯·鮑林建立或開發了電負性圖表。
4. 鮑林標度用於什麼?
鮑林標度用於確定原子(鍵合原子)的電負性。該標度表示鍵能和電負性之間的經驗關係。
5. 鮑林標度和穆利肯標度之間基本區別是什麼?
鮑林標度用於確定分子中原子的電負性,而穆利肯標度用於確定單個原子的電負性。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP