電子親和力
簡介
電子親和力是原子能量的變化。當一箇中性原子在其外層增加電子時,它會釋放能量並帶負電荷。元素獲得電子以穩定其八隅體。
元素接受或失去電子時會釋放能量。在化學反應中,當元素接受電子形成化合物時,它會釋放能量,這稱為放熱反應。釋放能量以吸引來自另一個元素的原子核的電子,這就是為什麼在放熱反應中會釋放能量的原因。當元素失去電子時,它會吸收能量,這被稱為吸熱過程。當原子失去電子時,原子會獲得能量。
什麼是電子親和力?
在化學反應中,分子會釋放或獲得能量。這種能量的釋放和獲得是透過獲得或失去電子來實現的。接受電子的原子會釋放能量,這些反應被稱為放熱反應。另一方面,在化學反應中失去電子的原子會吸收能量,被稱為吸熱反應。電子的親和力是接受電子的能力。當一箇中性的氣態原子接受電子時,它將帶負電荷形成負離子。第一電子親和力總是負的,第二電子親和力總是正的。很難測量原子的電子親和力。它是透過測量離子化合物的能量釋放來測量的。電子親和力也透過原子作為氧化劑或還原劑的趨勢來衡量。它以千焦/摩爾為單位測量。電子親和力用 Ea 表示。

第一電子親和力
當一箇中性原子接受一個電子時,能量被釋放,原子獲得負電荷。第一電子親和力總是負的,因為原子核需要更多的能量來吸引電子。
$$\mathrm{X(g)\:+\:e\:\rightarrow\:X(g)}$$
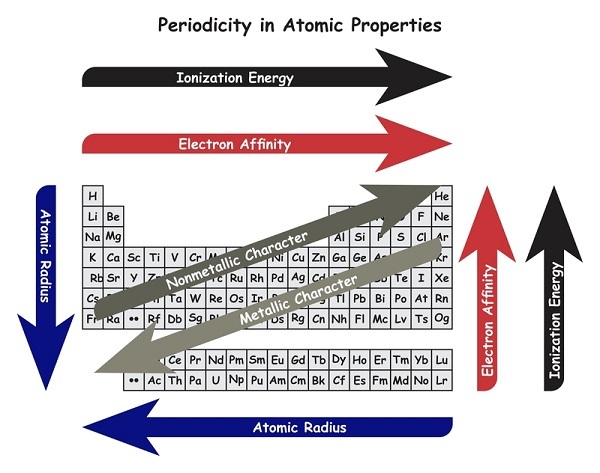
元素週期表中 16 族和 17 族元素表現出最佳的電子親和力。這些非金屬元素比釋放電子來完成其八隅體更有能力從其他元素中接受電子。
示例 - 氟原子和氯原子中第一個電子的電子親和力分別為 -328 kJ/Mol 和 -349 KJ/Mol。金屬的電子親和力較低,因為金屬更容易失去外層電子而不是獲得電子。金屬對其外層電子的吸引力較小,失去電子是一個吸熱過程。下表列出了金屬和非金屬的電子親和力。
金屬的電子親和力較低,因為金屬更容易失去外層電子而不是獲得電子。金屬對其外層電子的吸引力較小,失去電子是一個吸熱過程。下表列出了金屬和非金屬的電子親和力。
| 金屬 | 電子親和力 | 非金屬 | 電子親和力 |
|---|---|---|---|
| 𝐿𝑖 | -60 KJ/Mol | F | -328 KJ/ Mol |
| 𝑁𝑎 | -53 KJ/Mol | Cl | -349 KJ/ Mol |
| K | - 48 KJ/Mol | Br | -324 KJ/ Mol |
當我們在元素週期表中向下移動一個族時,電子親和力降低。
當我們在元素週期表中從左向右移動一個週期時,電子親和力增加。
金屬透過失去電子形成陽離子。
非金屬透過接受電子形成陰離子。
第二電子親和力
電子親和力在 16 族元素(如氧、硫和硒)中可見。向帶負電荷的元素(陰離子)新增電子所需的能量。這些形成 (-2) 離子的元素被稱為第二電子親和力。
向 1 摩爾 (-1) 氣態離子新增電子以形成 1 摩爾帶 -2 電荷的氣態離子所需的能量。
$$\mathrm{X(g)\:+\:e\:\rightarrow\:X^{-2}(g)}$$
示例 -
我們可以透過硫離子的例子來理解,
$$\mathrm{S(g)\:+\:e\:\rightarrow\:S^{-2}(g)}$$
$$\mathrm{S^{-1}(g)\:+\:e\:\rightarrow\:S^{-2}(g)}$$
方程式中硫的電子親和力為 -200 kJ/Mol。
在氧氣中,電子親和力 -
$$\mathrm{O(g)\:+\:e\:\rightarrow\:O^{-1}(g)\:EA\:=\:142KJ/Mol}$$
$$\mathrm{O^{-1}(g)\:+\:e\:\rightarrow\:O^{-2}(g)\:EA\:=\:+844KJ/Mol}$$
由於氧負離子中的電子-電子排斥,氧分子中的第二電子親和力高於第一電子親和力。
影響電子親和力的因素
有一些因素會影響分子的電子親和力,這些因素是元素的原子大小、分子上的核電荷以及原子的電子構型。
原子大小的影響 - 與原子尺寸較大的原子相比,原子尺寸較小的原子具有更大的電子親和力。較小原子的原子核對電子的吸引力比較大原子強。隨著原子尺寸的增加,外層電子遠離原子核,對電子外層電子的吸引力也會降低。
示例 - Br 的電子親和力高於 I,分別為 -324 KJ/Mol 和 -285 KJ/Mol。
核電荷 - 核電荷也會影響電子親和力。隨著原子電荷的增加,對電子的吸引力也增加,因此電子親和力也增加。如果分子已經帶電,則電子排斥力增加,原子核的吸引力也增加,因此帶電離子的電子親和力也增加。
示例 - 氧的第一次反應的電子親和力低於第二次電子親和力。
遮蔽效應 - 當我們降低原子內層的遮蔽效應時,電子親和力會增加。
$$\mathrm{電子親和力\:=\:\frac{1}{遮蔽效應}}$$
電子構型 - 電子構型也會影響電子親和力。具有完整八隅體的元素幾乎沒有接受電子的趨勢,因此惰性氣體的電子親和力為零。電子構型在電子親和力中起著至關重要的作用。由於金屬的電子構型,金屬對電子的親和力低於非金屬。
$$\mathrm{O(g)\:+\:e\:\rightarrow\:O^{-1}(g)\:EA\:=\:142KJ/Mol}$$
$$\mathrm{O^{-1}(g)\:+\:e\:\rightarrow\:O^{-2}(g)\:EA\:=\:+844KJ/Mol}$$
結論
電子親和力是在氣態形式下接受電子並形成陰離子的能力。接受電子會釋放能量,因此稱為放熱過程。當我們在族中從上到下移動時,電子親和力降低,當我們在週期中從左到右移動時,電子親和力增加。它用符號 EA 表示,並以千焦/摩爾 (KJ/Mol) 為單位測量。由於電子-電子排斥,第一電子親和力始終小於第二電子親和力。電子親和力受元素的原子大小、電子構型、遮蔽效應和核電荷的影響。
常見問題解答
1. 為什麼氟的電子親和力低於氯?
氟分子的原子尺寸小於氯分子,氟的外層電子已經充滿,原子核非常靠近外層電子,因此當我們在氟分子外層新增電子時,電子排斥力高於原子核的吸引力,與氯分子相比。
2. 為什麼硫分子的電子親和力高於氧分子?
當我們向下移動一個族時,分子的原子尺寸增加,電子親和力也降低,但硫是一個例外,因為硫的電子親和力為 -200 KJ/Mol,高於氧分子的 -142KJ/Mol。由於硫的尺寸較小,外層電子擁擠,原子核靠近外層電子,因此電子排斥力高於原子核的吸引力,這就是為什麼硫的電子親和力高於氧的原因。
3. 電子親和力是正的還是負的?
當電子被新增到元素中時,它是負的,因此最初的電子親和力是負的,但是當我們將電子新增到負離子時,它可能是正的或負的,這取決於電子排斥力。
4. 為什麼惰性氣體的電子親和力為零?
惰性氣體的電子親和力為零,因為惰性氣體的八隅體是完整的,它們對電子沒有親和力。這就是為什麼惰性氣體的電子親和力為零。
5. 為什麼 17 族表現出高電子親和力?
鹵素族的元素具有較高的電子親和力,因為鹵素的尺寸較小,外層電子較多。為了完成其八隅體,鹵素更容易接受一個電子而不是失去七個電子。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP