電子構型
簡介
電子構型描述了原子亞層內電子的分佈。預測圍繞原子核的電子位置的概述稱為電子構型。每個中性原子的電子數與質子數相同。現在,我們將這些電子進行排列,使它們圍繞原子核,顯示它們的能量以及它們所處的軌道型別。根據能量的不同,電子按照一定的順序佔據軌道。
什麼是電子構型?
電子構型描述了原子亞層內電子的分佈。
原子電子構型遵循一種標準方式,其中包含電子的每個原子亞層都按順序列出。
對於高原子序數,電子構型的通常表示可能相當冗長。在某些情況下,可以使用簡寫/縮寫符號來代替常規表示。
例如,Na的電子構型為$\mathrm{1s^2 2s^2 2p^6 3s^1}$。
亞層
電子在亞層中的分佈由角量子數決定,用字母“l”表示。
主量子數n的大小決定了這個量子數的大小。因此,當n等於4時,可以存在四個不同的亞層。
因此,s、p、d和f亞層分別對應於n=4時的l=0,1,2,3。
亞層所能容納的電子最大數量由公式2(2l+1)給出。
s、p、d和f亞層分別最多可以容納2、6、10和14個電子。
編寫電子構型
電子構型的書寫遵循三套規則。它們規定了如何確定每個元素的電子構型。能級是電子圍繞原子核旋轉的能量已知的距離。隨著距離原子核的距離增加,能級的相關能量也會增加。但是,對於多電子構型,電子能級圖很難被所有人記住。
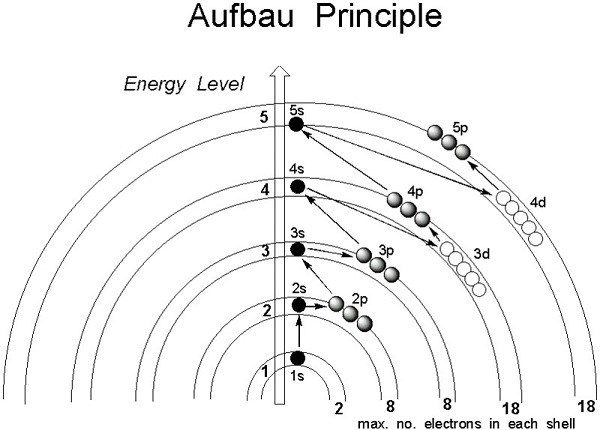
然而,透過理解Aufbau原理,可以描述電子構型。根據n+l規則,處於最低能量狀態的原子中原子軌道的電子按能量遞增的順序佔據軌道。能量隨著軌道的n+l值的增加而增加。如果兩個軌道具有相同的n+l值,則電子將首先填充n值較小的軌道,因為它具有較低的能量。因此,電子佔據以下順序:
$$\mathrm{1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,4f,5d,6p,7s…}$$
每個原子軌道最多隻能容納兩個自旋相反的電子。
因此,第一層可以在1s中容納兩個電子。第二層在2s中容納兩個,在2p中容納六個,總共可以容納8個電子。
此外,在按照順序將電子放入這些軌道時,也要遵循上述原則。
原子軌道的填充
以下概念支配著原子軌道中電子的佔據方式。
Aufbau原理
原子軌道的能量由主量子數和角量子數之和決定,根據Aufbau原理,電子首先進入能量相對較低的軌道,然後進入能量較高的軌道。
Chris Evans, Dr. Roger Peters, Dr. Mike Thompson, Chris Gadsby, Ken Partridge, Roy Mylan, Yehoshua Sivan, Tom Nation, Dr. David Follows, Vikash Hemnath Seeboo, Aufbau, CC0 1.0
泡利不相容原理
根據該原理,原子軌道中只能容納自旋相反的電子對,並且同一原子中沒有兩個電子的所有四個量子數都相同。
如果兩個電子具有相同的主量子數、角量子數和磁量子數,則它們應該具有相反的自旋。
洪特規則
在將第二個電子放置在軌道中之前,特定亞層中的每個軌道都應單獨填充電子。
原子電子構型的表示
在本節中,給出了幾個元素電子構型的示例。
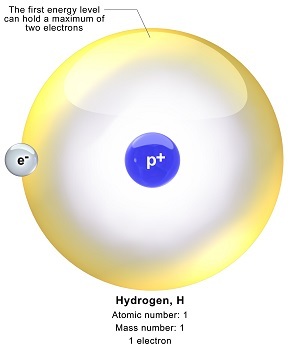
氫的電子構型
H的原子序數為1。因此,H原子具有1個電子,該電子將被分配到第一層/s軌道的亞層。H的電子構型為1s1。
BruceBlaus, Blausen 0529 HydrogenAtom, CC BY 3.0
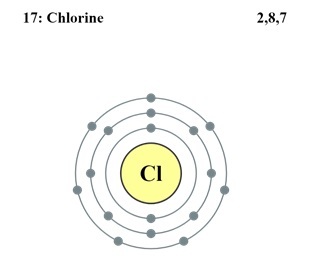
氯的電子構型
Cl的原子序數為17。因此,其17個電子分佈如下:
K層2個電子
L層8個電子
M層7個電子
以下是Cl的電子構型,可以表示為$\mathrm{1s^2 2s^2 2p^6 3s^2 3p^5}$。
Pumbaa (original work by Greg Robson), Electron shell 017 Chlorine, CC BY-SA 2.0 UK
結論
可以得出結論,電子構型是元素原子殼層內電子分佈的描述。該構型有助於確定這些電子的位置,因為這些電子在數學上位於這些亞層中。根據它們的電子構型,元素週期表將元素分為四類。這些由s、p、d和f區元素組成。主量子數決定了殼層中可以容納的電子最大數量(n)。電子在亞層中的分佈由角量子數決定,用字母“l”表示。
常見問題
1. 電子構型規則的例外情況有哪些?
鉻和銅是電子構型規則的兩個主要例外。在這些情況下,完全或半填充的d亞層電子構型比僅部分填充的電子構型更穩定,這導致來自4s軌道的激發電子躍遷到3d軌道。
2. 在n=3能級,哪些亞層是可能的?在這個能級上,有多少軌道是可能的?
我們知道亞層的數量取決於角量子數。給定n=3,l的值為0、1和2。因此,在n=3能級,有3個亞層——s、p和d是可能的。
對於n=3能級,我們有3個亞層——s、p和d亞層。據我們所知,s亞層有一個軌道,p有三個軌道,而d亞層有五個。因此,n=3能級總共有九個軌道。
3. 元素具有特定的電子構型為什麼很重要?
透過識別原子的價電子,電子構型可以闡明其化學行為。此外,它有助於將元素組織到不同的區域,如s、p、d和f區。
4. 列出電子構型的重要性。
重要性如下:
它們有助於確定原子的反應性狀態。
它有助於識別其化學和物理特性。
它預測原子的磁性。
5. n=3有哪些亞層?
一個軌道最多可以容納2個電子,對於n=3,存在4個亞層——s、p、d和f。對應於s、p、d和f亞層的軌道最大數量分別為1、3、5和7。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP