極性與非極性之間的區別
簡介
在兩個相互連線的原子之間,極性鍵具有不相等數量的電子,而非極性鍵似乎具有相等比例的電子。如果不同和相似元素的原子結合,就會產生分子,但是當兩個原子共享一對電子時,就會產生共價鍵。根據相關的電子如何在它們所結合的元素之間分配,原子之間的共價鍵被分類為極性或非極性。
什麼是極性鍵?
極性鍵是一種共價鍵。當兩種或多種元素的電負性差異大於0.4且小於1.8時,它們之間存在極性鍵。極性鍵不均勻地共享電子,因此電子的負電荷通常不會在整個分子中均勻分佈。這導致偶極矩。當鍵的一端為正,另一端為負時,就會產生偶極矩。氫原子和氧原子之間的水鍵是極性鍵最著名的例子。由於明顯的1.4的巨大電負性差異,這種鍵被歸類為極性鍵。由於O原子電負性更強,H原子中的電子更傾向於O原子中的電子。
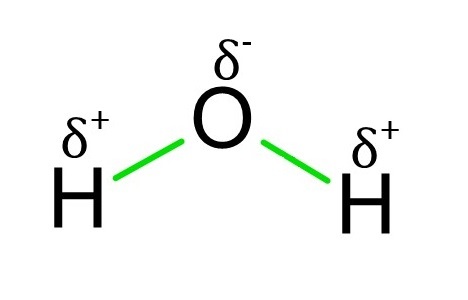
極性鍵的識別
如果分子的某一側略帶正電荷,而另一側略帶負電荷,則該分子為極性分子。這種鍵中的原子也可以貢獻和放棄電子。因此,相對較近地保留電子的元素將比其他元素帶負電荷更多。電負性是決定元素吸引電子的關鍵因素。電負性值將幫助您識別兩個原子之間的鍵是極性鍵還是非極性鍵。當兩個分子之間的電負性差異在0.4到1.8之間時,就會形成極性共價鍵。
什麼是非極性鍵?
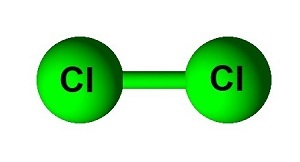
另一種共價鍵是非極性鍵。非極性鍵均勻地共享電子。非極性鍵是由兩個或多個具有相同電負性或電負性差異小於0.4的元素形成的鍵。Cl2鍵是非極性鍵的一個例子。Cl2由兩個氯原子組成。這兩個原子之間的電負性差異為零,它們均勻地共享電子。
非極性鍵的識別
可以存在兩種型別的鍵:純極性鍵和非極性鍵。當原子電負性差異遠小於0.4時,會形成非極性化學鍵;當它大於1.8時,會形成離子鍵。
極性與非極性
儘管一個分子可能包含極性共價鍵,但這並不一定是一個極性化合物。由於極性分子中存在總偶極矩,因此它們排列不均勻。以極性分子水為例。它們具有相當大的不可抵消的部分正電荷。另一方面,它可以交換整個電子並具有對稱的極性鍵,這可以平衡某種型別的淨偶極矩。以三氟化硼為例,其中極性鍵排列在一個平面上並相互中和。下表顯示了這兩種物質的區別:
| 極性 | 非極性 |
|---|---|
| 極性分子具有均勻的電子密度分佈。 | 電子密度的不均勻分佈導致非極性分子。 |
| 極性化合物的非對稱排列 | 它們具有對稱的極性鍵。 |
| 除非分子的偶極矩為0,否則該分子為極性分子。例如水。 | 非極性物質的偶極矩為零。例如,CCl₄。 |
極性化合物和非極性化合物之間的區別
| 極性化合物 | 非極性化合物 |
|---|---|
| 極性分子間相互作用是強力,導致形成氫鍵和偶極-偶極鍵。 | 最弱的力是構成倫敦色散力的非極性分子間力。 |
| 極性化合物存在淨偶極矩。 | 非極性分子沒有淨偶極矩。 |
| 原子間的電負性差異 > 0.4。 | 原子間的電負性差異 < 0.4。 |
| 極性分子具有較高的熔點和沸點。 | 非極性化合物具有較低的熔點和沸點。 |
| 極性分子的蒸氣壓低。 | 非極性分子的蒸氣壓高。 |
| 極性化合物的表面張力強。 | 非極性化合物的表面張力低。 |
| 極性分子在結構上是不對稱的,中心原子周圍有孤對電子。 | 非極性分子是對稱的,沒有未共享電子。 |
| 極性分子包含一個或多個共價鍵。 | 並非所有非極性化合物都需要具有非極性共價鍵。 |
| 例如水、HF和CHCl₃。 | 戊烷、己烷和CO₂是一些例子。 |
結論
化學反應決定了原子和元素中鍵的極性。這也被稱為兩個電子甚至原子的共享。自然界中存在兩種型別的共價鍵:極性和非極性。分子的電負性決定其極性或非極性。當一個或多個分子比其他分子更具電負性時,就會形成共價鍵、極性鍵和離子鍵。電子與負電荷的共享產生電偶極子。電偶極子是負電荷相對於正電荷的位移。
常見問題
1. 為什麼極性物質不溶於非極性物質?
由於溶劑和溶質粒子之間相反電荷的明顯吸引力,極性溶劑將溶解極性和離子溶質。雖然它們不能吸引偶極子和離子,但非極性溶劑只能溶解非極性溶質。
2. 分子能否形成極性鍵?
在極性鍵中,成鍵電子沒有被均勻共享,導致鍵能。但是,根據其形狀,分子可能是極性的也可能是非極性的。
3. 如果水不是極性的會怎樣?
水將無法運輸營養物質——無論是植物還是人體——也無法溶解和運輸人體內的廢物。人類將無法用鹽來調味開水、湯和燉菜,因為它不會溶解在水中,從而不會帶來額外的味道。
4. 極性物質和非極性物質哪種蒸發得更快?
更極性的化合物將更緊密地結合在一起,並且比極性較低的化合物蒸發得慢。由於它們彼此之間的吸引力較小,因此極性較低的分子可以快速蒸發。
5. 非極性分子能否穿過細胞膜?
因為像O₂和CO₂這樣的小非極性分子可溶於脂質雙層,所以它們可以很容易地穿過細胞膜。像H₂O這樣的小的非極性分子可以穿過膜,而像葡萄糖這樣的大得多的非極性分子則不能。


 資料結構
資料結構 網路
網路 關係資料庫管理系統(RDBMS)
關係資料庫管理系統(RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP