平衡態變化實驗過程
引言
當系統受到干擾時,就會觀察到平衡狀態的變化。然而,平衡態變化實驗是在實驗室受控條件下進行的。勒夏特列原理闡述了平衡態變化的概念,並與平衡常數相關聯。反應中的平衡態變化對平衡狀態的影響相當顯著。可以據此預測反應方向的變化。
勒夏特列原理
在化學反應中,可以透過改變反應條件來改變化學平衡的狀態。平衡狀態的變化稱為**脅迫**。因此,如果對給定系統的平衡狀態施加脅迫,則反應將不再處於平衡狀態。
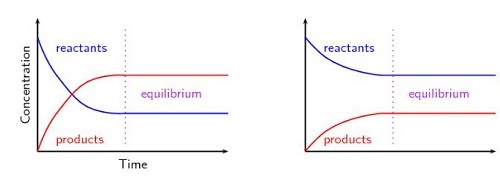
圖1 - 勒夏特列原理的圖形表示
根據勒夏特列原理,增加或減少產物或反應物的摩爾數、壓力、溫度以及平衡反應中任何其他變化都會導致顯著的變化,同時向前或向後移動以釋放脅迫。
平衡常數
平衡常數是描述任何反應平衡狀態的必要方面。產物分子濃度與反應物分子濃度的比率稱為平衡常數。然而,在特定溫度下,平衡速率保持不變。
目的和目標
下面提到的實驗的目的是為了理解平衡態的變化,以展示反應平衡和平衡常數之間的關係。然而,實驗中考慮的是鐵離子和硫氰酸根離子的反應,其中增加或減少離子的濃度以觀察脅迫對反應平衡狀態的影響。
所需材料
此實驗室實驗需要某些特定材料,如下所述:
實驗中使用了陶瓷製成的點板、兩根玻璃攪拌棒、一塊熱板和一個250毫升的廢液收集燒杯。需要MicroLab分光光度計和四個MicroLab分光光度計小瓶。

圖2 - “所需材料”
將0.100克氯化鐵溶液加入0.100克硫氰酸鉀中,然後進一步加入去離子水。
步驟
在這個實驗中,採取了一些步驟來獲得正確和準確的讀數,並採取了預防措施。如果測量不正確,則實驗結果無效。取10毫升0.1摩爾/升的FeCl₃溶液到量筒中,並將其與10毫升0.1摩爾/升的KSCN一起倒入乾淨的燒杯中。由於形成了產物絡合物分子[Fe(SCN)(H₂O)₅]²⁺(aq),出現了深紅色。用50毫升蒸餾水稀釋產物分子。現在將溶液倒入四個燒杯中並施加脅迫。
預防措施
進行實驗需要採取一些預防步驟,如下所述:
使用的試管應具有精確的直徑。
此實驗室實驗需要稀釋的硫氰酸根溶液來進行實驗。
比較是根據實驗過程中觀察到的顏色的強度進行的。反應完成後出現的顏色被認為是實驗的參考顏色。
觀察結果
觀察表列舉如下:
| 試管 | 在平衡狀態下新增的物質 | 顏色變化 | 對[Fe(SCN)(H₂O)₅]²⁺濃度的影響 | 在平衡狀態下觀察到的變化 |
|---|---|---|---|---|
| A | 5毫升水 | 參考顏色 | 不適用 | 不適用 |
| B | 5毫升0.1摩爾/升FeCl₃溶液 | 顏色趨於加深 | 增加 | 向右移動 |
| C | 5毫升0.1摩爾/升KSCN溶液 | 顏色趨於加深 | 增加 | 向右移動 |
| D | 5毫升0.1摩爾/升KCl溶液 | 顏色變淺 | 增加 | 向左移動 |
表1 - 在各種條件下平衡狀態的變化
結論
在本教程中,重點介紹了實驗室實驗,解釋了給定反應的平衡狀態可能發生的變化。然而,勒夏特列原理指出,如果引入脅迫,則會發生平衡態的變化。藉助該原理解釋了實驗分析。
常見問題
1. 為什麼平衡實驗只能用稀溶液進行?
平衡實驗只能用稀溶液進行的原因是,為了便於處理和理解在反應中產生各種脅迫時的顏色變化。此外,濃溶液由於在施加脅迫時會產生大量的熱,可能會對實驗室造成嚴重的損害。
2. 為什麼平衡實驗中要使用相同尺寸的沸騰管?
沸騰管是尺寸較小的圓柱形容器,用於在實驗室條件下用本生燈火焰強烈加熱物質。在平衡實驗中使用相同尺寸的沸騰管的原因是為了獲得要新增的溶液的精確測量值,以便參考。
3. 平衡常數與速率常數有何不同?
平衡常數與反應物的初始濃度無關,而速率常數取決於溫度等方面。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統 (RDBMS)
關係型資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP