如何製備羧酸?
簡介
羧酸也被稱為烴氧化產物。羧酸是烴的衍生物,由一個或多個氫原子被羧基取代形成。
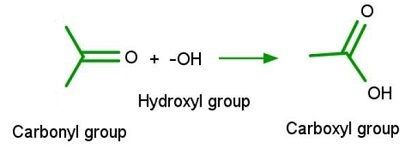
含有羧基的有機化合物稱為羧酸。它們是化學中一個重要的官能團。它們的命名來源於它們所組成的羰基(C=O)和羥基(-OH)基團。它們具有不同於羰基和羥基的特性。根據羧基的數量,它們被分為一元羧酸、二元羧酸和三元羧酸。
羧酸的結構
根據最近的光譜學和衍射研究,酸基(-COOH)是平面的。即(-COOH)基團的碳原子以及2個氧原子都是sp2雜化的,而烷基碳原子是sp3雜化的。
因為R基團有一個未配對的sp3雜化軌道,它與碳的sp2雜化軌道軸向排列,形成σ鍵。
C原子發生了sp2雜化。最後一個pz軌道垂直於由3個sp2軌道形成的平面。一個sp2軌道與R基團的sp3軌道對齊。最後的2個與2個氧原子的sp2軌道重疊,形成2個σ鍵。
一個氧原子發生sp2雜化。最後一個pz軌道平行於平面。一個sp2雜化軌道與碳的sp2雜化軌道對齊,形成σ鍵。另外兩個sp2雜化軌道帶有孤對電子。
第二個氧原子也共平面,其中一個sp2雜化軌道與氫的s軌道重疊,形成σ鍵。
所有3個位於垂直於平面的pz雜化軌道可以在整個軌道影像中側向重疊,形成π鍵。因此,這些軌道是離域的。
羧酸的製備方法
一些主要的羧酸製備方法如下。
由格氏試劑製備羧酸
在無水乙醚存在下,格氏試劑與二氧化碳(乾冰)反應生成羧酸鹽,然後用無機酸酸化得到羧酸。

由醇製備羧酸
重鉻酸鉀以及瓊斯試劑在酸性介質中,或常用的氧化劑如高錳酸鉀在中性、酸性或鹼性介質中,都能快速將伯醇氧化成羧酸。
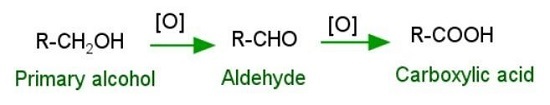
由醛製備羧酸
羧酸也可以由醛(-CHO)用中等強度的氧化劑合成。醛在受到常用的氧化劑作用時,會迅速轉化為羧酸。

由酯製備羧酸
鹼性水解生成羧酸鹽,羧酸鹽酸化後生成相應的羧酸,而酯的酸性水解則直接生成羧酸。

由醯滷和酸酐製備
當醯氯用水解時,會形成羧酸。當醯氯用鹼性水溶液水解時,會形成羧酸根離子,羧酸根離子酸化後生成相應的羧酸。相反,酸酐用H_2 O水解生成相應的酸。

由腈和醯胺製備
腈在H+或OH-作為催化劑存在下,水解生成醯胺,然後生成酸。在這個反應中,溫和的反應條件是優選的,以便反應可以在醯胺階段終止。

由烷基苯製備
烷基苯可以用鹼性或酸性高錳酸鉀或鉻酸氧化生成芳香族羧酸。無論側鏈長度如何,整個側鏈都被氧化成羧基。伯和仲烷基被氧化,但叔烷基不被氧化。這些氧化劑也可以將適當取代的烯烴轉化為羧酸。

羧酸轉化為醇
羧酸轉化為醇是一個簡單的過程。羧酸使用如無水乙醚或四氫鋁鋰等試劑還原。羧酸中的-COOH基團被轉化為-CH_2 OH,一個伯醇基團。
羧酸的用途
有機酸用於食品工業,製備鈉鹽、醋和其他軟飲料,而苯甲酸鈉則用於防腐。
乙酸用於化工行業,製備香料、人造絲和染料等。
乙酸用於橡膠製造行業,生產橡膠。
羧酸,如硬脂酸,是生產洗滌劑和肥皂中最重要的酸。
在尼龍工業中,己二酸用於生產過程中。
苯甲酸酯用於製造身體噴霧、香水和其他化妝品。
乙醯水楊酸用於製藥行業,製備非那西汀、阿司匹林和其他藥物。
結論
羧酸被歸類為烴的衍生物。COOH基團中可取代的H原子的存在賦予了羧酸其酸性。根據最近的光譜學和衍射研究,酸基(-COOH)是平面的。羧酸可溶於水。羧酸的沸點遠高於相同分子量的烷烴或醇。根據與COOH相連的基團的型別(烷基或芳基),它們被分類為脂肪族或芳香族化合物。
常見問題
1. 酸的沸點比相應的醇高。給出原因。
由於酸的兩個分子之間存在分子間氫鍵,因此酸的沸點較高。由於二聚體的形成,有效分子量變為正常質量的兩倍,從而提高了沸點。此外,由於酸具有比醇更極性的-OH基團,因此酸中的氫鍵更強,從而提高了酸的沸點。
2. 為什麼羧酸被稱為脂肪酸?
因為高階羧酸是由脂肪和油的分解形成的,所以羧酸被稱為脂肪酸。
3. 用LiAlH_4處理酯然後進行酸性水解的結果是什麼?
$$\mathrm{Ph-COO-CH_2-Ph+LiAlH_4→Ph-CH_2-OH+Ph-CH_2-OH}$$
4. 以下哪一個酸性更強?
CH3 COOH 或 CH2 FCOOH,
甲酸或苯甲酸
由於負電性的F原子導致電子從COOH中被拉出,並有助於H+的釋放,因此CH2 FCOOH比CH3 COOH酸性更強。
甲酸比苯甲酸酸性更強,因為HCOOH中O上的負電荷比苯甲酸中更離域。
5. 說明羧酸的物理性質。
C1-C3羧酸(脂肪族)是具有刺激性氣味的無色腐蝕性液體。C4-C9羧酸是具有腐敗黃油氣味的油狀液體。高階酸是無味的蠟狀固體,密度遠低於水。
羧酸的沸點遠高於相同分子量的烷烴或醇。
羧酸可溶於水,因為它們可以與H2 O分子形成氫鍵。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP