烯烴的親電加成反應
介紹
在雙鍵上進行加成反應生成飽和產物似乎是最常見的烯烴反應。烯烴是不飽和烴,這意味著它們至少具有一個雙鍵。由於π電子的存在(e-),它們顯示了親電試劑(電子接受試劑)如何靶向碳-碳雙鍵(C=C)以產生加成產物。這些被稱為烯烴的親電加成反應。這些反應也可能受自由基機制的控制。烯烴經歷了許多反應,例如氧化和臭氧化。
定義加成反應
化學中有許多型別的化合物,例如烯烴和炔烴。每種型別表現不同並具有不同的特性。烯烴也進行多種反應。此過程涉及親核試劑(電子給予試劑)、親電試劑或自由基新增到諸如烯烴、炔烴、醛和酮之類的化合物中。加成反應是消除反應的逆反應。

電子異構效應是導致加成反應的主要過程。此反應不會產生副產物。
親電加成反應
在化學中,有許多型別的化合物,例如烯烴和炔烴。不同的型別有其個性和一組特徵。當兩個或多個分子反應形成一個更大的分子時,就會發生加成反應。所得分子稱為加合物。有機化學中有兩種型別的加成反應。加成反應的兩類是親電加成反應和親核加成反應。
親電加成反應機理
烯烴是一種烴類,每個分子中至少含有一個雙鍵。由於這個雙鍵,烯烴發生加成反應。當親電試劑(電子接受試劑)利用烯烴的π電子(e-)靶向碳原子的雙鍵時,就會發生烯烴的親電加成反應。它有時也採用自由基機制。
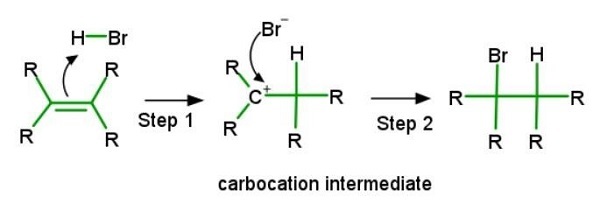
烯烴有各種各樣的加成反應。研究親電加成反應機理的最基本解釋是氫鹵酸(如溴化氫和氯化氫)的加成。親電加成的第一步是用親電試劑攻擊碳-碳雙鍵(C=C),這產生了電子(e-)對。這被稱為去質子化步驟。結果,釋放的電子(e-)與分子結合。它現在只有一個帶正電荷的碳-碳鍵。這被稱為碳正離子過程。然後鹵化物連線到下一步。
通常,氫鹵酸表示為HI>HBr>HCl。
馬氏規則
一位名叫馬爾科夫尼科夫的科學家提出了一條預測規則。這條規則被稱為馬爾科夫尼科夫規則。此規則可用於確定反應產物。如果反應的負(-ve)部分連線到碳原子,則生成的產物在大多數反應中將具有較少的氫(H)原子。由於加成分子既有負(-ve)部分也有正(+ve)部分,因此它只顯示負部分。對於對稱烯烴,這種方法比不對稱烯烴更容易獲得產物。這意味著在這種情況下,乙烷是對稱烯烴,而丙烷是不對稱烯烴。

可以使用溴化氫觀察親電過程。在碳正離子反應期間,溴化氫靶向碳-碳雙鍵(C=C)。它產生帶正電荷的H+。由於仲碳正離子比伯碳正離子穩定得多,因此溴離子靶向碳正離子原子,導致烷基鹵化物的形成。
利用親電加成反應生成酮和醇
如果親電加成過程在氧化狀態下發生,則會形成酮和醇。高錳酸鉀(KMnO4)可用於生成酮和醇。如果高錳酸鉀呈酸性,則烯烴在氧化後會生成酮。在冷卻的水性環境中,烯烴將被高錳酸鉀(KMnO4)氧化,生成鄰二醇。

烯烴氧化時,會生成酮和醇。在冷的高錳酸鉀(KMnO4)水溶液存在下,烯烴氧化成鄰二醇,而酸性高錳酸鉀氧化成酮或酸。
因此,烯烴可用於各種化學過程中,例如親電加成反應。當一組化合物在不同狀態下暴露於一系列相互作用時,每種化合物都會以不同的方式反應。與氧化一樣,它可以在不同溫度下與其他化學物質發生狀態變化。因此,在進行任何反應之前,瞭解其概念和重要性至關重要。
結論
因此,當使用烯烴時,尤其是在親電加成反應中,可以建立不同的化學反應。當一組化合物在不同狀態下進行不同的反應時,每個組都會以獨特的方式反應。與氧化一樣,這可能在不同溫度下以不同的化學物質在其他狀態下發生變化。親電取代和加成過程由親電試劑進行。根據第一個試劑的進攻,加成反應被分類為親核、親電或自由基。親核加成反應通常在醛和酮中觀察到。親電中心的出現引發了親核加成過程。親電加成伴隨著親核加成,產生穩定的產物。馬爾科夫尼科夫規則用於找到最穩定的碳正離子。
常見問題
1. 提及一些涉及烯烴試劑的親電加成反應。
一些最常見的烯烴試劑的親電加成反應是普林斯反應、硼氫化-氧化反應、羥汞化反應以生成水和乙酸汞以及水合反應、氫化反應、鹵化氫加成和二滷加成反應。
2. 親電試劑(電子接受試劑)是離子正的嗎?
鑑於親電試劑(電子接受試劑)可能被帶負電荷的離子(如親核試劑(電子給予試劑))吸引,因此可以假設親電試劑(電子接受試劑)具有完全的正電荷或至少部分正電荷以實現相反電荷的吸引。
3. 為什麼說氫和氟的加成反應是最慢的?
由於 H-F 鍵的強度,氫和氟的加成反應確實是最慢的。與元素週期表中的其他鹵素相比,氫 (H) 和氟 (F) 之間的鍵很難斷裂。因此,H-F 的完整加成反應比其他反應慢。
4. 什麼誘導了烯烴的親電加成反應?
雙鍵和 sp2 雜化的烯烴中的電子 (e-) 可以透過 p 軌道的側向重疊移動,從而使π鍵透過親電加成到親電試劑(電子接受試劑)。
5. 為什麼烷烴不能進行加成反應?
由於烷烴目前僅具有單鍵,因此它們不會變得更結構穩定或更強。因為它們已經達到了最大容量,並且只能在取代反應中改變周圍的事物。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP