原電池和電解池的區別
電池是一種能夠將化學能轉化為電能的裝置。電池由兩個電極和內部的化學物質組成。當電池連線到電路時,電池內部會發生化學反應,這些化學反應的結果是在電路中產生電流。
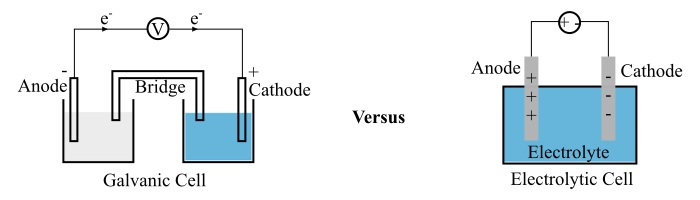
在本文中,我們將討論原電池和電解池,以及這兩種型別的電池彼此之間有何不同。
什麼是原電池?
原電池是一種電化學電池,它利用自發的氧化還原反應產生電流。
原電池由兩個半電池組成,每個半電池都包含一個浸在電解質中的電極。這兩個電極彼此分離,以防止氧化和還原反應直接接觸,從而產生電位差。
當原電池的電路閉合時,氧化反應中釋放的電子會透過外部電路到達另一個電極,最終這些電子會被還原反應利用。透過這種方式,原電池在外部電路中建立電流。
什麼是電解池?
電解池也是一種電化學電池,它利用來自外部電源的電能來驅動化學反應。
一個典型的電解池主要有三個部分:兩個電極(陽極和陰極)和一個電解質。其中,電解質是水和熔融鹽(例如氯化鈉)的溶液,其中溶解了離子。
當電壓施加到電極上時,電解質中的離子會被吸引到極性相反的電極。電解池被廣泛用於電解分解化合物。
原電池和電解池的區別
原電池和電解池都是電化學電池的型別。然而,原電池和電解池之間存在許多差異,在下表中列出:
| 差異依據 | 原電池 | 電解池 |
|---|---|---|
| 定義 | 原電池是一種電化學電池,其中化學能轉化為電能。 | 電解池是一種電化學電池,其中電能轉化為化學能。 |
| 能量轉換 | 在原電池中,化學能轉化為電能。 | 在電解池中,電能轉化為化學能。 |
| 電極極性 | 對於原電池,正極稱為陰極,負極稱為陽極。 | 對於電解池,陽極為正極,陰極為負極。 |
| 電子流動 | 帶負電的電子從原電池的陽極流向陰極。 | 電子從電解池的陰極流向陽極。 |
| 化學反應 | 在原電池中發生自發的化學反應以釋放電能。 | 在電解池中,發生非自發的化學反應。 |
| 是否需要外部電壓源 | 原電池不需要外部電壓源。 | 電解池需要外部電壓源。 |
| 電能流動 | 在原電池中,電能從電池流向外部電路。 | 在電解池中,電能從外部電路流向電池。 |
| 電池容器數量 | 原電池需要兩個單獨的電池容器,形成兩個由鹽橋連線的半電池。 | 一個電池容器構成完整的電解池。 |
| 電極上的離子 | 在原電池中,離子在陰極放電,在陽極消耗。 | 電解池的兩個電極都會放電離子。 |
| 氧化和還原反應 | 在原電池中,氧化反應發生在陽極,還原反應發生在陰極。 | 在電解池中,氧化反應發生在陰極,還原反應發生在陽極。 |
| 應用 | 原電池用作電源,用於電池等。 | 電解池用於電解提純金屬等。 |
結論
原電池和電解池之間最顯著的區別在於,原電池將化學能轉化為電能,而電解池將電能轉化為化學能。

廣告

 資料結構
資料結構 網路
網路 RDBMS
RDBMS 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP