氯乙酸
簡介
氯乙酸最早由法國化學家費利克斯·勒布朗於1843年製備。他透過在陽光下簡單地氯化乙酸使其成為可能。1857年,一位名叫萊因霍爾德·霍夫曼的德國化學家透過在氯氣和陽光存在下回流冰醋酸製備了氯乙酸。同年,法國化學家查爾斯·阿道夫·武爾茨透過氯乙醯氯的水解制備了氯乙酸。
什麼是氯乙酸?
氯乙酸是一種化學名稱,可以定義為有機氯化合物。它可以表示為$\mathrm{C_{2}H_{3}O_{2}Cl}$。它也被稱為一氯乙酸或MCA。它可以透過誘導效應簡單地分散負電荷來增加乙酸的酸度,並且它可以透過穩定乙酸根陰離子發揮作用。簡單來說,它可以由乙酸衍生而來。$\mathrm{C_{2}H_{3}O_{2}Cl}$既可以作為除草劑,也可以作為烷基化劑。
氯乙酸的結構
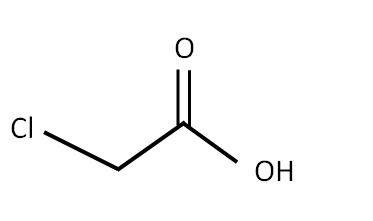
圖1 - 氯乙酸的結構
$\mathrm{C_{2}H_{3}O_{2}Cl}$也稱為2-氯乙酸或氯乙酸。氯羧酸帶有2-氯取代基,並且$\mathrm{C_{2}H_{3}O_{2}Cl}$本質上是無色或淺棕色結晶固體。它在水中表現出兩種性質。它可以溶於水,甚至可以沉入水中。如果將其熔化成液體形式,則會導致熱燒傷。此外,如果它與皮膚接觸或被攝入、吸入或吸收,它會顯示其毒性。除此之外,$\mathrm{C_{2}H_{3}O_{2}Cl}$是可燃的和腐蝕性的。
氯乙酸的性質
氯乙酸的化學式為$\mathrm{C_{2}H_{3}O_{2}Cl}$。氯乙酸的分子量為94.49 g/mol。$\mathrm{C_{2}H_{3}O_{2}Cl}$的密度為1.58 g/cm3。氯乙酸的沸點和熔點分別為189.3°C和63°C。$\mathrm{C_{2}H_{3}O_{2}Cl}$的晶體本質上是吸溼性的。它可能是無色的,但具有與醋一樣強烈的氣味。在火災條件下,它可以形成許多有害的分解產物。分解會導致產生氯化氫氣體和碳氧化物。
氯乙酸的製備
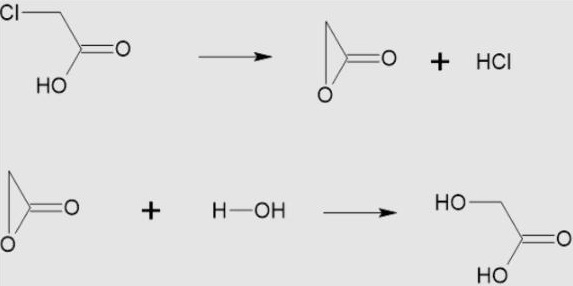
圖2 - 氯乙酸的水解
氯乙酸的水解,知識共享署名-相同方式共享4.0,來自維基共享資源
用於工業用途,氯乙酸可以透過兩種主要方法制備。在全球範圍內,如果按年測量,每年至少製備420,000噸氯乙酸。它們是主要方法,包括三氯乙烯的水解。
第一種方法是指主要方法,廣泛用於生產氯乙酸。該過程涉及乙酸的氯化,其中乙酸酐充當催化劑。化學反應可以表示為:
$$\mathrm{H_{3}C\:-\:COOH\:+\:Cl_{2}\:\rightarrow\:ClH_{2}C\:-\:COOH\:+\:HCl}$$
這種方法的一個主要缺點是它會產生兩種雜質,如二氯乙酸和三氯乙酸。
第二種方法包括三氯乙烯的水解。在這種方法中,水解在濃硫酸的濃溶液中於130-140°C進行,其中濃度至少為75%。可以表示化學反應的方程式為:
$$\mathrm{ClHC\:=\:CCl_{2}\:+\:2H_{2}O\:\rightarrow\:ClH_{2}C\:-\:COOH\:+\:HCl}$$
此過程的結果被認為是高純度的產品,這是該方法與主要方法之間的基本區別。
氯乙酸的用途
氯乙酸可用於許多領域。它用作氯乙酸乙酯生產中的中間體。它也被廣泛用作抑菌劑和除草劑。它可以用作防腐劑和化學中間體。它被認為是農藥、藥物和染料生產領域的關鍵組成部分。最重要的是,它用於製備增稠劑羧甲基纖維素和羧甲基澱粉。氯乙酸是有機化學中最基本成分之一。
關於氯乙酸的重要事實
健康危害
由於氯乙酸本質上是有毒的,因此它可以對人體造成致命傷害,劑量為50-500 mg/kg。如果它與皮膚接觸,會導致刺激和灼燒感。它甚至可能導致抑鬱和呼吸系統抑制。
安全措施
關於氯乙酸最重要的一點是它具有可燃性。
藉助它,可能會發生熱燒傷。
它在腐蝕組織和金屬時表現出其毒性。
結論
氯乙酸是有機化學領域中非常重要的元素,也被稱為MCA。這是一種羧酸,被認為對構建有機合成中的基石很有用。與氯乙酸相關的化合物有二氯乙酸和三氯乙酸。
常見問題
1. 氯乙酸的主要用途是什麼?
氯乙酸是一種類似沙子的材料,主要用於製造染料、化學品、除草劑,甚至消毒劑。
2. 氯乙酸的基本性質是什麼?
氯乙酸被認為是最強的酸。它比乙酸更酸性。
3. 如何製備氯乙酸?
氯乙酸可以透過不同的方法制備。但是,製備氯乙酸最常見的方法是在催化有效量的乙酸酐、乙醯氯存在下氯化乙酸。
4. 最有害的酸是什麼?
氫氟酸被認為是列表中最危險和最有害的酸。它甚至不會完全解離在水中。
5. 最強的酸是什麼?
世界上最強的酸是碳硼烷酸,它甚至比硫酸更強。碳硼烷酸是一種超強酸,可以儲存在容器中。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP