鹼的含義
引言
鹼的定義有很多種,但三種定義中共同的一點是:鹼與酸反應生成中性化合物(鹽)和水。這一定義由G.-F. Rouelle提出。這種化合物中存在的離子賦予它特徵的性質。阿侖尼烏斯提出,氫氧根離子OH⁻的存在導致鹼的特徵性質。根據布朗斯特-勞裡鹼理論,鹼是一種可以接受質子或氫離子H⁺的物質。而在路易斯鹼理論中,鹼是可以給出電子對的化合物。
“鹼”這個術語是什麼意思?
鹼是指任何溶於水後具有滑膩感、苦味,並且能使紅色石蕊試紙變藍的物質。它能與酸反應生成中性化合物(鹽)和水作為副產物。氫氧化鈉和氨是鹼的例子。它們是含有兩種離子的離子化合物:帶正電荷的金屬離子和帶負電荷的非金屬離子。它們透過離子鍵結合在一起。溶於水時,這種離子鍵會解離。如果鹼性溶液的pH值高於7,則其值會隨其強度而變化。
圖片即將推出
阿侖尼烏斯鹼
鹼的第一個定義是由阿侖尼烏斯在1884年提出的。根據這一鹼理論,鹼是一種離子化合物,溶於水後會解離產生氫氧根離子或OH⁻離子。或者說是能增加溶液中OH⁻離子濃度的物質。這種離子化合物的解離會產生帶負電荷的物質(氫氧根離子)和帶正電荷的金屬離子。例如,氫氧化鈉NaOH是一種阿侖尼烏斯鹼。其解離反應為:
$$\mathrm{NaOH(aq)\to Na^{+}(aq)+OH^{-}(aq)}$$
氫氧化鈣Ca(OH)₂也是一種鹼,含有兩個氫氧根離子。其解離反應為:
$$\mathrm{Ca(OH)_{2}(aq) \to Ca^{2+}(aq)+2\:OH^{-}(aq)}$$
這些化合物也能與酸反應生成相應的鹽。氫氧化鈉與鹽酸反應生成氯化鈉和水。反應式為:
$$\mathrm{2\:HCl+NaOH\to NaCl+H_{2}O}$$
這種反應稱為中和反應,因為它涉及到相應的鹽和水的形成,它們相互中和了彼此的性質。
布朗斯特鹼
布朗斯特-勞裡理論根據氫離子的接受或給予性質來處理酸和鹼。因此,布朗斯特鹼是一種接受氫離子H⁺的化學物質。而酸是可以給出氫離子的物質。由於它們接受的是帶正電荷的離子,所以它們必須至少含有一對孤對電子。因此,根據布朗斯特理論,氨鹼可以與酸(例如鹽酸HCl)反應,接受來自HCl的質子。反應式為:

這是由於氨分子中存在孤對電子的緣故。其中,鹽酸中的質子從HCl轉移到氨分子。該反應的產物也是由酸和鹼的中和反應生成的鹽。從阿侖尼烏斯理論的角度來看,氨不是鹼。
路易斯鹼
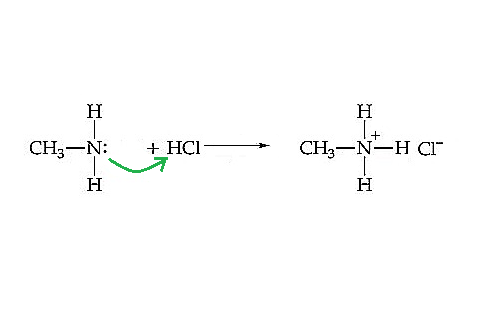
路易斯鹼理論是科學家G.N. Lewis在1923年提出的。該理論克服了布朗斯特理論的不足之處,因為它只關注質子的接受和給予。相反,路易斯理論的目標是電子轉移。因此,根據這一理論,路易斯鹼是可以給出電子對的化合物。因此,該化合物必須至少含有一對孤對電子。而酸是接受鹼給出的電子對的物質。甲胺CH₃NH₂(路易斯鹼)與鹽酸HCl(酸)的中和反應如下所示。
鹼的型別
根據氫氧根基團的數量和鹼的強度,鹼可以分為不同的型別。基於氫氧根基團數量的鹼分類是基於阿侖尼烏斯概念的,分為三種類型。下面將詳細討論。
一元鹼 - 僅含有一個氫氧根基團OH⁻的鹼是一元鹼。它們只能與一個氫原子結合。例如氫氧化鉀KOH。
二元鹼 -顧名思義,它是一種含有兩個氫氧根離子的鹼。並且可以與兩個氫原子結合。例如氫氧化鈣Ca(OH)₂。
三元鹼 -顧名思義,它含有三個氫氧根基團。並且可以與酸的三個氫原子結合。例如氫氧化鋁Al(OH)₃。
基於鹼的強度或其產生相應離子的電離度的分類是:
強鹼 - 可以完全解離成各自離子的鹼,或具有高電離度的鹼是強鹼。這種鹼的pH值在13-14之間。氫氧化鈉是一種強鹼。
弱鹼 - 電離度低的鹼是弱鹼。或者它不能解離成各自的離子。這種鹼的pH值比強鹼低,在7-10範圍內。氫氧化銨NH₄OH是一種弱鹼。
什麼是鹼?它們與鹼有何不同?
鹼是由鹼金屬或鹼土金屬形成的離子化合物。它們也是一種可以溶於水的鹼。所有的鹼都是鹼性的,但並非所有的鹼都是鹼性的。這意味著鹼不能溶於水形成溶液。而鹼溶於水後會產生pH值大於7的鹼性溶液。一些重要的鹼有氫氧化鈉、氫氧化鋁、碳酸鋰等。
鹼的物理性質
下面討論鹼的一些物理性質。
鹼具有肥皂性。
它們嚐起來有苦味。
鹼可以使紅色石蕊試紙變藍。
它們不能用手觸控,因為它們對皮膚有很強的腐蝕性。
它們與酸性化合物接觸時會形成鹽。
鹼的例子
所有鹼性化合物至少含有一對孤對電子。下面給出一些鹼的例子。
NaOH(氫氧化鈉)
KOH(氫氧化鉀)
LiOH(氫氧化鋰)
Al(OH)₃(氫氧化鋁)
NH₃(氨)
CsOH(氫氧化銫)
結論
鹼是重要的化合物,其pH值大於7,可以與酸性化合物反應生成鹽。鹼有三種不同的分類:阿侖尼烏斯理論、路易斯理論和布朗斯特理論。這三種理論都提到了鹼與酸反應生成相應鹽的情況。鹼分為一元鹼、二元鹼和三元鹼,這取決於氫氧根基團的數量。還有一種鹼的分類是基於鹼的解離度。鹼是一種溶於水的鹼,而鹼則不能。所有的鹼都是鹼性的。鹼具有肥皂性和苦味。氫氧化鈉、氨等是鹼的例子。
常見問題
Q1. 日常生活中鹼的例子是什麼?
A1. 一些常用的家用鹼包括肥皂、泡打粉、牙膏、洗衣粉、漂白劑等。
Q2. 牛奶是鹼嗎?
A2. 不是,牛奶不是鹼。它是一種酸性物質,因為它含有乳酸。牛奶的pH值在6-7之間。
Q3. 鹼有什麼用途?
A3.
鹼廣泛用於製造肥皂和清潔劑。
抗酸劑含有鹼。
用於鹼性電池。
排水管和烤箱清潔劑的主要成分。
在製藥工業中。
Q4. 血是鹼性的嗎?
A4. 血的pH值為7.35-7.45。任何pH值高於7的化合物都是鹼性的。因此,血液是鹼性的,也是鹼性緩衝液的一個例子。
Q5. 蜂蜜是鹼性的嗎?
答:蜂蜜是一種酸性化合物,而不是鹼性化合物。蜂蜜的pH值很低,可以阻止微生物的生長。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統 (RDBMS)
關係型資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP