什麼是未飽和溶液?
簡介
未飽和溶液需要溶質分子更多地溶解到溶液中。 能夠分解溶質的不同型別的溶劑顯示出與其原始溶劑明顯不同的物理特性。 一旦溶質的所有特性都被溶劑吸收,兩種不同成分就會呈現出共同的相似之處。
飽和溶液的型別
溶液的型別如下:
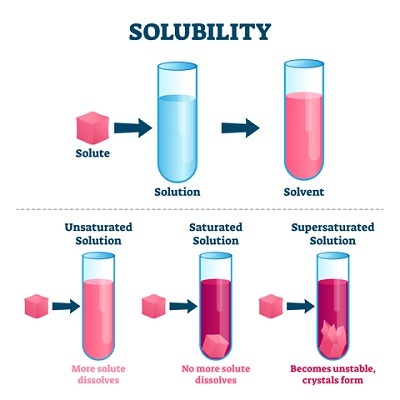
圖1:飽和溶液的型別
未飽和溶液
未飽和溶液是指溶劑可以溶解更多濃度的溶質顆粒。 它也表明溶液尚未達到飽和點。
飽和溶液
溶劑在其分子間距離內吸收最大量溶質顆粒的溶液稱為飽和溶液。 在這種情況下,一杯水在室溫下最多能溶解10克糖。 因此,該溶液可以被認為是糖水的飽和溶液。 因為水分子之間沒有更多空間容納單個糖單元。
過飽和溶液
過飽和溶液是一種超過飽和水平的溶液。 例如,一杯水最多溶解10克糖,即使再加入10克糖也會導致溶液過飽和。 因為水分子之間沒有更多空間容納糖分子,導致多餘的糖分子沉澱在杯底。
未飽和溶液的製備
溶劑可以是固態、液態或氣態,能夠溶解任何固態、液態或氣態顆粒作為溶質。 溶液包含少量溶質的物理性質以及一些純溶劑的性質。
對於均相溶液,溶劑和溶質處於相同的物質狀態,因此溶液的物理性質與其純態的性質沒有變化。 例如,用糖、鹽和水製成的清涼飲料;其中存在一種溶劑和兩種溶質。 這兩種溶質是均質的,一旦這兩種溶質混合到一杯水中,它們的物理形狀就不會保留。

圖2:過飽和溶液的製備
Cuterjeans,過飽和溶液,CC BY-SA 4.0
過飽和溶液的製備是一個非常簡單的過程,可以確定特定溶液的最大飽和限度。 因此,製備未飽和溶液的過程被認為是一個溶劑限制過程,其中溶劑充當溶質量的限制劑。 例如,如果一杯水能夠溶解10克糖,那麼只倒入2克糖。 溶質最終不會溶解,這意味著飽和過程仍然完成。 這定義了溶劑不能溶解更多溶質並達到其過飽和點。
改變未飽和溶液的步驟
改變未飽和溶液的步驟分為三種分類。 第一步是向溶劑中新增更多溶質,以幫助其達到飽和點。 在這種情況下,必須將溶質倒入溶劑中並攪拌,直到溶質不再溶解。 第二種方法是加熱飽和溶液。
透過失去溶劑的屬性,飽和溶液會變成過飽和狀態。 糖水溶液在沸騰時會將水汽化。 因此,水的體積減少,但溶質的量保持不變。 因此,未飽和溶液一段時間後會變成過飽和溶液。
未飽和溶液的性質
未飽和溶液的性質如下:
未飽和溶液很容易受到不同型別溶質新增的影響。
它能夠吸收更多量的溶質顆粒,因為其溶劑部分仍然在溶劑分子之間的分子間空間中留有空位。
在密閉條件下加熱飽和溶液會導致溶劑分子之間的分子間空間增大,並且可以溶解更多量的溶質分子。 因此,透過在密閉條件下加熱飽和溶液可以將其轉化為未飽和溶液。
這些是一些未飽和溶液的特性。
飽和溶液和未飽和溶液的區別
| 飽和溶液 | 未飽和溶液 |
|---|---|
| 當飽和溶液的溫度升高時,它會轉化為未飽和溶液,需要更多量的溶質才能恢復到飽和點。 | 當未飽和溶液被加熱時,除非需要更多量的溶質顆粒才能達到飽和點,否則不會發生顯著變化。 |
| 當溫度開始下降時,溶液的飽和點開始下降,在較低的溫度下,它會變成過飽和溶液,溶液底部有多餘的溶質顆粒。 | 當溫度下降到某個點以下時,不飽和點會降低,溶液很容易達到飽和點。 |
| 溶質的沉澱是可見的,因為溶劑沒有更多空間溶解溶質顆粒。 | 溶劑中留有大量空間來溶解溶質。 因此,這是一個零沉澱的情況。 |
表1:飽和溶液和未飽和溶液的區別
結論
本教程解釋了日常活動中飽和溶液的含義。 學習者能夠理解溶液如何變得不飽和。 有些步驟能夠討論改變未飽和溶液狀態的基本方法。 透過改變影響飽和水平的因素來獲得該過程。
常見問題
Q1. 影響溶劑溶解度的因素有哪些?
答:已知影響溶質溶解度的兩個主要因素是溶液的溫度和壓力。
Q2. 微溶液體是什麼意思?
答:由於溶質和溶劑的各種物理性質,這種型別的液體無法利用分子間空間完全溶解溶質顆粒。 因此,溶質部分溶解,大量溶質無法溶解到溶劑中。
Q3. 極性溶質在什麼狀態下能夠溶解?
答:溶劑的極性有助於利用極性分子或離子相互作用溶解極性溶質。 大多數可溶性溶質都處於這種狀態,在這種狀態下,同化過程很可能會發生。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP