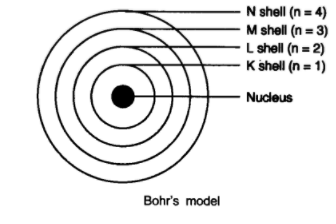
描述玻爾的原子模型。
玻爾的原子模型
(1) 原子中心有一個原子核。
(2) 電子圍繞原子核旋轉。
(3) 原子內部允許存在某些特殊的軌道,稱為電子的離散軌道。
(4) 電子在離散軌道上旋轉時不輻射能量。
(5) 這些軌道或殼層稱為能級。
(6) 這些軌道或殼層用字母 K、L、M、N 或數字 n = 1、2、3、4 表示。
[額外資訊: 玻爾的原子模型由尼爾斯·玻爾於 1915 年提出。玻爾原子模型的假設如下
- 在原子中,電子(帶負電)圍繞帶正電的原子核在稱為軌道或殼層的特定路徑上旋轉。每個軌道或殼層都具有固定的能量,這些圓形軌道被稱為軌道殼層。
- 能級用整數 (n=1、2、3…) 表示,稱為量子數。該量子數範圍從原子核到側面,n=1 具有最低能級。軌道 n=1、2、3、4… 分別指定為 K、L、M、N… 殼層,當電子達到最低能級時,據說處於基態。
- 原子中的電子透過獲得所需的能量從較低能級躍遷到較高能級,而電子透過損失能量從較高能級躍遷到較低能級。
- 電子只能在角動量量子化的軌道上運動,即電子的角動量是 h/2π 的整數倍。]

廣告

 資料結構
資料結構 網路
網路 關係資料庫管理系統
關係資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP