溫度的動理論解釋
簡介
物質有五種狀態,氣體是其中之一。空隙被氣體填充。大氣充滿了氣體分子。它包含不同的氣體分子。氧氣分子是呼吸所必需的,也存在於我們的大氣中,以及許多其他氣體分子。宇宙中的一切物質都由稱為分子的微小粒子組成。它們彼此之間存在一定的吸引力。分子之間存在分子間引力。
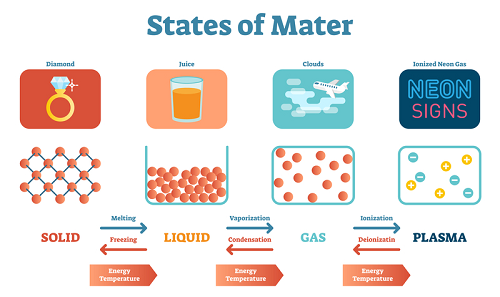
根據分子之間的吸引力,物質被分為五類。它們分別是固體、液體、氣體、等離子體和玻色-愛因斯坦凝聚態。固體是分子間距離非常小且緊密結合在一起的物質。液體是分子間距離較小且結合不如固體緊密的物質。等離子體狀態的分子具有較高的動能。
氣體動理論的假設
氣體動理論描述了氣體的熱力學行為。它們有一些基本的假設,如:
氣體中存在許多稱為粒子的微小粒子。
它們彼此之間以及與容器壁發生彈性碰撞。
這些粒子彼此相同,並且可以向所有可能的方向運動。
碰撞時間與碰撞之間的時間相比非常小。
與氣體的總體積相比,分子的體積非常小。
除了碰撞時,分子之間不施加任何力。
分子之間的距離大於分子的尺寸。
所有分子都遵循運動定律。
溫度的動理論解釋是什麼意思?
讓我們考慮一個容積為V的充滿氣體的容器。假設分子以所有可能的速度運動。那麼氣體分子對器壁施加的壓力由下式給出:
$\mathrm{P=\frac{1}{3}\frac{mnc^2}{v}}$
其中m表示一個分子的質量。n表示分子的數量。$\mathrm{C^2}$表示分子的均方根速度。V表示氣體的體積。
1摩爾氣體包含N個分子。
$\mathrm{PV=\frac{1}{3}mNC^2}$
根據氣體定律PV=RT
$\mathrm{RT=\frac{1}{3}mNC^2}$
$\mathrm{\frac{RT}{N}=\frac{1}{3}mC^2}$
在等式右側乘以2併除以2,我們得到:
$\mathrm{\frac{RT}{N}=\frac{2}{3} \times \frac{1}{2} mC^2}$
分子的動能為$\mathrm{K.E=\frac{1}{2}mC^2}$
$\mathrm{\frac{RT}{N}=\frac{2}{3} \times K.E}$
$\mathrm{K.E=\frac{3}{2}\times \frac{RT}{N}}$
$\mathrm{K.E=\frac{3}{2} KT}$
其中$\mathrm{K=\frac{R}{N}}$表示玻爾茲曼常數。
動能與溫度之間的關係
作用於物體的功就是其能量。由於運動而具有能量的物體稱為其動能。它可以從一個物體轉移到另一個物體,也可以轉化為其他形式的能量。這種能量取決於其質量和速度。動能的SI單位是焦耳。因此,物體的動能由下式給出:
$\mathrm{K.E=\frac{1}{2} mc^2}$
根據能量均分定理,分子的自由度不同;系統的總能量被平均分配到分子的每個自由度上。平均分配的能量為1/2 kT。這稱為能量均分定理。因此,氣體的溫度與分子的動能直接相關。
氣體定律
為了瞭解氣體的行為,提出了許多定律。氣體定律給出了壓力、溫度和體積之間的關係。它們是查理定律、蓋-呂薩克定律、阿伏伽德羅定律、波義耳定律和格雷厄姆定律。
波義耳定律:波義耳定律明確指出,氣體的壓力與其體積成反比。(即)當壓力增加時,體積會減小。只要溫度保持恆定,就會保持這種關係。數學表示如下:
$\mathrm{P \varpropto \frac{1}{v}}$
$\mathrm{PV = k\:(常數)}$
查理定律:當溫度升高時,氣體膨脹。查理定律解釋了這一點。它表明,當壓力保持恆定時,氣體的體積隨溫度的變化而直接變化。
$\mathrm{V \varpropto T}$
$\mathrm{\frac{v}{T} = k(常數)}$
蓋-呂薩克定律:當氣體的體積保持恆定時,氣體的壓力隨溫度的變化而直接變化。這稱為蓋-呂薩克定律。
$\mathrm{P \varpropto T}$
$\mathrm{\frac{P}{T} = k(常數)}$
阿伏伽德羅定律:阿伏伽德羅定律指出,在相同溫度和壓力下,相同體積的氣體中,分子數量相同。
$\mathrm{V \varpropto n}$
$\mathrm{\frac{v}{n} = k}$
格雷厄姆定律:根據他的原理,較輕的分子比較重的分子運動得更快。即,在恆定壓力和溫度下,低分子質量分子的擴散速度快於高分子質量分子的擴散速度。擴散時間內的分子與它們質量密度的平方根成反比。
$\mathrm{r \varpropto \frac{1}{\sqrt{P}}}$
結論
在本教程中,詳細討論了氣體動理論的假設和溫度的動理論解釋。還討論了動能與溫度以及氣體定律之間的關係。
常見問題
Q1. 解釋自由度。
A1. 描述分子位置所需的座標數稱為自由度。通常,單原子分子具有三個自由度。具有多個原子的分子包括三個額外的自由度,如平動、轉動和振動。根據此,具有多個原子的分子的自由度會有所不同。
Q2. 說明氣體中的平均自由程。
A2. 在氣體中,分子彼此之間以及與容器壁發生碰撞。分子在任意兩次連續碰撞之間行進的距離的平均值稱為平均自由程。用λ表示。
Q3. 影響氣體行為的因素有哪些?
A3. 影響氣體行為的因素有溫度(T)、壓力(P)、體積和數量。如果氣體的溫度升高,氣體膨脹,從而體積增加。類似地,由於氣體分子壓縮,溫度降低時體積也降低。溫度升高會導致氣體膨脹,因此其壓力也會升高,反之亦然。要將氣體轉化為固體或液體,溫度必須非常低。數量和壓力彼此成正比。由於壓力與體積和數量成正比,因此可以透過提高數量和體積來增加壓力。
Q4. 列出氣體定律的一些應用?
A4. 如果環境條件發生變化,則氣體分子的行為會偏離其正常行為。氣體定律可以很好地研究這些變化。用於吸入液體的注射器遵循波義耳定律的原理。蛋糕和麵包在加熱時膨脹遵循查理定律。它也用於天氣預報系統。它們還用於熱力學和流體動力學。
Q5. 氣體是如何被壓縮的?
A5. 氣體是物質的一種狀態,其中分子鬆散地結合在一起。因此,分子之間存在許多空隙。當對氣體施加壓力時,這些空隙會減小,粒子會靠得更近。從而體積減小,氣體被壓縮。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP