硫酸氫根
介紹
硫酸根離子化學式為SO₄²⁻,帶有兩個負電荷。四個氧原子圍繞中心原子硫。它是硫酸的鹽。
硫酸用鹼(氫氧化鈉)部分中和會生成硫酸氫鈉,NaHSO₄。這種鹽的相應離子是**硫酸氫根**,HSO₄⁻。這就是它被稱為硫酸氫鈉的原因。這種化學物質的母體化合物是硫酸,這也是它具有酸性的原因。但與硫酸相比,它的酸性較弱,因此在許多需要弱酸性化合物的場合,它經常被用作硫酸的替代品。
什麼是硫酸氫根?
**硫酸氫根**是硫酸的鹽,化學式為HSO₄⁻,以離子的形式存在,即陰離子。**硫酸氫根**含有氫、硫和氧三種元素。它也是一種含氧硫酸根陰離子。它是硫酸根的共軛酸,具有酸性,並具有優良的化學性質。硫酸氫根也稱為硫酸氫根,因為它存在於硫酸氫鈉NaHSO₄中。這種化合物的基本單元來源於硫酸H₂SO₄。它們是弱酸,常在某些反應需要弱酸性但即使稀釋的硫酸也不能使用的情況下使用。**硫酸氫根**也是硫酸失去一個質子的去質子化形式。
硫酸氫根的結構
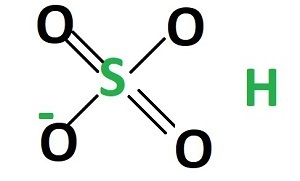
**硫酸氫根**包含一個硫原子、四個氧原子和一個氫離子。**硫酸氫根**的結構與甲烷分子類似,為四面體結構,結構如下:
硫酸氫根的化學反應
這種化學物質有很多化學反應。下面列出了一些反應。
它與水反應生成水合氫離子和硫酸根離子。反應式為:
**硫酸氫根**與硝酸根離子反應生成硫酸根離子和亞硝酸。反應式為:
$$\mathrm{HSO_{4}^{-}\:+\:H_{2}O\rightarrow\:H_{3}O^{+}\:+\:SO_{4}^{2-}}$$
$$\mathrm{HSO_{4}^{-}\:+\:NO_{2}^{-}\:\rightarrow\:SO_{4}^{2-}\:+\:HNO_{2}}$$
硫酸氫根的用途
**硫酸氫根**有很多用途。其弱酸性和獨特的化學性質使其在實驗室和其他工業用途方面非常有用。其中一些列在下面。
它用於廢水處理,去除氯殘留物。
**硫酸氫根**用於替代液態二氧化硫。
**硫酸氫根**的鈉鹽用於製備硝石渣。
它用於生產硫酸。
它用於生產三氧化硫。
硫酸氫根和硫化氫有什麼區別?
**硫酸氫根**和硫化氫是重要的含硫化合物。硫化氫的化學式為H₂S,而**硫酸氫根**的化學式為HSO₄⁻。儘管它們含有相同的元素,但這些化合物的物理和化學性質是不同的。這兩種化合物的部分區別如下表所示。
| 硫酸氫根 | 硫化氫 |
|---|---|
| 這種化學物質沒有氣味。 | 這種化學物質有特有的氣味,像臭雞蛋味。 |
| **硫酸氫根**天然存在於多種岩石、沉積物和土壤中。 | 植物和動物組織分解會產生硫化氫。 |
| 該化合物中存在的離子是SO₄²⁻ | 該化合物中存在的離子是S²⁻ |
| 高濃度的這種化合物對人體健康有害,會導致脫水。 | 它是一種有毒化學物質,甚至會腐蝕金屬。 |
解答示例
例1
1) 如何求出硫酸氫根中S的氧化數?
瞭解其他元素的氧化態有助於計算未知元素的氧化態。**硫酸氫根**中的硫(S)的氧化態可以透過這種方式找到。氫的氧化數為+1,氧的氧化數為-2。**硫酸氫根**的總電荷為-1。因此,可以透過將硫的氧化態設為x來計算氧化態或氧化數。
$$\mathrm{1\:+\:x\:+\:(-2)\:\times\:4\:=\:-1}$$
$$\mathrm{1\:+\:x\:-\:8\:=\:-1}$$
$$\mathrm{x\:-\:7\:=\:-1}$$
$$\mathrm{x\:=\:+6}$$
因此,**硫酸氫根**中S的氧化數為+6。
例2
2) 我們都知道,硫酸氫根或HSO₄⁻在水中既可以作為鹼也可以作為酸。那麼,在下列哪個方程式中,硫酸氫根充當酸,為什麼?
$\mathrm{HSO_{4}^{-}\:+\:H_{2}O\rightarrow\:H_{2}SO_{4}\:+\:OH^{-}}$
$\mathrm{HSO_{4}^{-}\:+\:OH^{-}\:\rightarrow\:H_{2}SO_{4}\:+\:O_{2}^{-2}}$
$\mathrm{HSO_{4}^{-}\:+\:H_{2}O\:\rightarrow\:SO_{4}^{2-}\:+\:H_{3}O^{+}}$
$\mathrm{HSO_{4}^{-}\:+\:H_{3}O^{+}\rightarrow\:SO_{3}\:+\:2H_{2}O}$
酸是一種釋放其中質子的化合物。因此,在給定的方程式中,釋放H⁺或H₃O⁺離子的反應被認為是**硫酸氫根**可以充當酸的反應。第三個選項是一個**硫酸氫根**充當酸的反應的例子,因為生成了H₃O⁺。反應式為:
$$\mathrm{HSO_{4}^{-}\:+\:H_{2}O\rightarrow\:SO_{4}^{-2}\:+\:H_{3}O^{+}}$$
所有其他方程式都是**硫酸氫根**透過失去OH⁻離子或接受H⁺離子而充當鹼的反應的例子。
結論
**硫酸氫根**是一種無機鹽,化學式為HSO₄⁻,所以它是陰離子。它也稱為硫酸氫根,因為它存在於硫酸氫鈉中。它主要由硫酸製得,因此它具有中等酸性,並且經常在許多化學反應中用作硫酸的替代品。**硫酸氫根**具有四面體幾何形狀,硫位於中心,所有氧原子都圍繞它。這種化合物的用途包括廢水處理以及其他重要化學品的製備。硫化氫也是另一種含硫化合物。但**硫酸氫根**和硫化氫是具有不同性質的不同化合物。
常見問題
1. 硫酸氫根的熔點是多少?
**硫酸氫根**的熔點為59℃。這是硫酸氫鈉這種硫酸氫鹽的熔點。
2. 硫酸氫根的pH值是多少?
**硫酸氫根**是一種弱酸鹽,pH值為1。
3. 硫化氫的用途是什麼?
硫化氫用於製備硫、無機化合物的硫化物,這些硫化物可用於製造殺蟲劑、染料、醫藥產品等。它也用於製備硫酸、重水等。
4. 什麼是脫水?
涉及失去水分子的過程或化學反應稱為脫水。它是水合過程的反向反應。有幾種脫水劑,硫酸就是一個重要的例子。**硫酸氫根**在特定數量下也充當脫水劑。
5. 硫酸氫根是否溶於水?
這種化合物的鈉鹽硫酸氫鈉,NaHSO₄,在水中中等溶解度。幾乎所有金屬硫酸鹽都溶於水。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP