吉布斯自由能變化
介紹
吉布斯自由能變化與熱力學第二定律有關,熱力學第二定律指出系統的熵以及周圍環境的熵必須始終增加。熵是系統能量位移的度量,如果它能夠儲存能量。因此,吉布斯自由能對於理解許多方程式至關重要,因為它闡明並簡化了宇宙中所有自發事件。
在恆定溫度和壓力下,可以轉化為功的內能的一部分稱為自由能。自由能具有能量的特性,其值由系統的狀態決定,而不是由其歷史決定。如果化學過程中反應物的吉布斯自由能大於產物的自由能,則熵增加,並且該過程變得自發。
吉布斯自由能簡介
它作為熱力學引數來估計在恆定壓力和溫度下,熱力學隔離系統可以完成的最大功。它也作為在這些條件下可能發生的化學過程等過程的先決條件。
在恆定壓力和溫度下,自由能變化是非膨脹且可以從封閉環境中提取的最大功。此限制只能透過可逆方法達到。
在任何條件下,都可以量化反應過程中系統自由能發生的改變。如果資料是在標準狀態條件下收集的,則得到反應的吉布斯自由能標準值。
$$\mathrm{\Delta\:G\circ\:=\:\Delta\:H\circ\:-\:T\Delta\:S\circ\:}$$
描述系統自由能的方程很有用,因為它可以突出熵和焓部分作為特定反應主要驅動力時的相對重要性。兩種力的平衡控制著過程是否自發以及在反應過程中系統自由能的變化量化。
吉布斯能量
在19世紀中期,約西亞·吉布斯發明了吉布斯能量。他最初將系統中的這種能量稱為“可用能量”。他1873年發表的一篇論文詳細介紹瞭如何使用他的方程式來預測系統在連線時的行為。與化學反應相關的能量可用於做功,它是系統焓減去熵和溫度的乘積。
$$\mathrm{\Delta\:G\:=\:\Delta\:H\:-\:T\Delta\:S}$$
𝛥𝐺可以認為是在恆定壓力和溫度下存在的可用功的數量。首先,假設在恆定壓力和溫度下給定的反應是唯一發生的反應。系統釋放或吸收的熵對應於周圍環境必須吸收或釋放的熵。只有當宇宙的總熵變為0或正時,反應才會被允許。這產生一個負的𝛥𝐺,並且該反應被稱為放能過程。
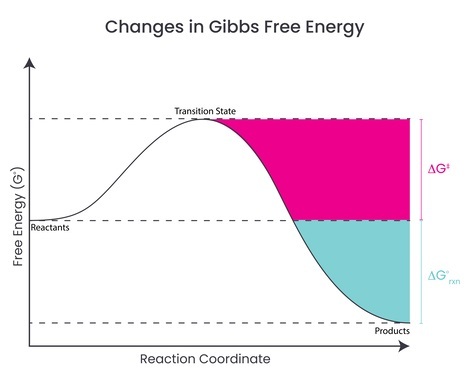
在恆定溫度和壓力下,可以轉化為功的內能的一部分稱為自由能。在恆定溫度下,可以轉化為功的焓的一部分。
因此,它是自由焓,而TS是被限制的焓或可能是等溫不可及的焓。因此,“自由焓”似乎比其他名稱“吉布斯自由能”或“吉布斯勢”更好。在熱力學中,處於平衡狀態的系統具有自由能,這是一種類似能量的屬性或狀態函式。自由能具有能量的特性,其值由系統的狀態決定,而不是由其歷史決定。
自由能與平衡常數之間的關係
反應的標準自由能變化G°類似於反應物和產物在其標準狀態下的自由能形成變化,並且與反應在平衡時的任何階段的自由能變化delta G有關。解釋如下:
$$\mathrm{\Delta\:G\:=\:\Delta\:G\circ\:+\:RTlnk_{eq}}$$
Q=反應商。
在平衡狀態下,∆G變為0,反應商變為平衡常數。
$$\mathrm{\Delta\:G\circ\:=\:-RTlnk_{eq}}$$
$$\mathrm{\Delta\:G\circ\:=\:-2.303RTlnk_{eq}}$$
$\mathrm{R\:=\:8.314\:I/mol/k}$
如果化學過程中反應物的吉布斯自由能大於產物的自由能,則熵增加,並且該過程變得自發。
吉布斯自由能與電池電動勢之間的關係
電池可獲得的最大功是透過其傳輸電荷的最大電動勢乘以每摩爾流動的電荷。
$$\mathrm{\Delta\:G\:=\:-nFE_{cell}}$$
其中
$\mathrm{E_{cell}\:=\:電池的電動勢}$
n = 電子數
$\mathrm{F\:=\:96500\:Cmol^{-1}}$
結論
可以得出結論,吉布斯自由能是熱力學系統以能量形式產生的可用功的度量。它用G表示。需要吉布斯自由能或G、焓和熵的值進行計算。焓是物理或化學系統的熱含量度量。
熵是在任何給定單位溫度下系統中產生的熱能量,這些能量無法用於有意義的工作。$\mathrm{\Delta\:G\circ\:=\:\Delta\:H\circ\:-\:T\Delta\:S\circ\:}$是計算自由能的公式。它在物質的標準狀態下執行,對應於標準條件,例如1摩爾濃度、1個大氣壓和298開爾文。如果化學反應中反應物的吉布斯自由能超過產物的自由能,則熵會增加,並且該過程會變得自發。
常見問題
1. 為什麼吉布斯自由能在平衡時為0?
在平衡狀態下,系統處於動態平衡狀態。正向和逆向反應同時存在。如果正向方向的吉布斯能量變化為G,則逆向方向的吉布斯能量變化為-G。因此,在平衡狀態下,吉布斯能量為0。
2. 溫度對吉布斯自由能有什麼影響?
隨著溫度升高,自由能的值降低。如果𝛥𝑆為正,則隨著溫度升高,−𝑇𝛥𝑆變得越來越負。因此,自由能降低。
3. 為什麼相變的自由能為0?
在相變時,自由能並不總是零。但是,由於吉布斯函式本質上取決於熱力學變數p和T,並且因為當p和T恆定時,摩爾吉布斯函式在相變過程中很可能保持恆定。
4. 吉布斯自由能的影響是什麼?
吉布斯能量會影響電化學電池的電勢以及可逆過程的平衡值
5. 什麼導致熵發生變化?
當物質被分成多個組分時,熵會增加。因為溶質顆粒在溶液形成時彼此分離,所以溶解過程會增加熵。隨著溫度升高,熵會增加。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP