酸鹼性質實驗
介紹
酸鹼性質實驗是化學中最重要的話題之一。通常,嚐起來酸的化學物質會將藍色石蕊試紙變紅,這些物質被稱為酸。類似地,嚐起來苦的鹼會將紅色石蕊試紙變藍。酸和鹼相互反應會生成鹽和水。這表明中和作用,即鹼和酸都中和成水的pH值。
如果不對這些事實進行測試和實驗,它們只會停留在假設階段。因此,本文將包含酸鹼性質實驗。將進行三個實驗,每個實驗都使用HCl作為酸,NaOH作為鹼。這些將與石蕊試液(藍/紅)、鋅金屬和碳酸鈉(固體)等化合物一起測試。
酸鹼性質實驗所需材料
進行酸鹼性質實驗需要各種材料,包括:
火柴盒
滴管
試管架
試管夾
酒精燈
分液漏斗
石蕊試液或試紙(紅色和藍色)
試管
平底燒瓶
鋅粒
石灰水(現配現用)
燒杯
碳酸鈉(固體)
稀NaOH溶液
稀HCl溶液

圖1:所需化學藥品和材料清單
(Nefronus, 鋅樣品, CC0 1.0) (Ondřej Mangl, 碳酸鈉, 標記為公共領域,更多詳情請見維基共享資源) (Walkerma at en.wikipedia, 鹽酸 04, 標記為公共領域,更多詳情請見維基共享資源) (Ondřej Mangl, 氫氧化鈉, 標記為公共領域,更多詳情請見維基共享資源) (Deamit, 使用石蕊試紙測定水樣pH值, CC BY 4.0)
什麼是酸?

圖2:常見的無機酸和乙酸
溶於水後生成帶正電荷的水合氫離子(H3O+)的化合物稱為酸。
例如,HNO3釋放NO3-和H+離子,就像HCl釋放H+和Cl-離子一樣。
酸的性質實驗
實驗1:石蕊試驗
取兩個試管,並將它們放在試管架上。
現在,將兩個試管分別標記為1和2。
取試管1,加入5毫升藍色石蕊試液。
現在在試管2中加入5毫升紅色石蕊試液。
現在,用滴管吸取HCl溶液,在試管1和2中分別加入等量。
仔細觀察試管中顏色的變化。
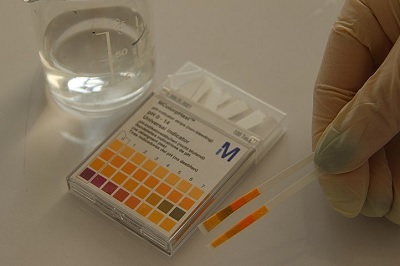
圖3:石蕊試驗
Deamit, 使用石蕊試紙測定水樣pH值, CC BY 4.0
實驗2:碳酸鈉(固體)
取一個平底燒瓶,加入1克碳酸鈉和少量蒸餾水。
現在取一個(乾燥的雙孔)軟木塞。這個軟木塞應該適合分液漏斗。此外,還應在其上安裝一個導氣管。
現在,用乾燥的雙孔軟木塞塞住平底燒瓶的瓶口。然後加入2毫升HCl氣體。
釋放的氣體無色無味。然後,該氣體透過石灰水和導氣管。
透過石灰水後,石灰水開始變渾濁。
該實驗涉及的反應是
$$HCl + Na_2CO_3 \rightarrow 2NaCl + H_2O(液態) + CO_2(氣態)$$
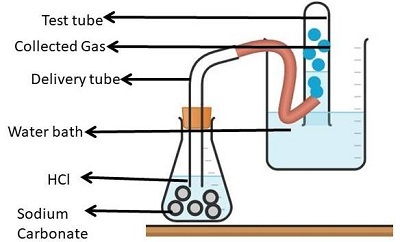
圖4:碳酸鈉對HCl酸的作用
實驗3:鋅
取一個(乾淨乾燥的)試管,放入鋅粒。
將HCl溶液(液態)倒入試管中,使鋅粒浸沒在其中。
現在稍微傾斜試管,並用軟木塞將其塞緊。
將本生燈固定在試管上,然後點燃。
現在將試管口緊緊塞住。這應確保沒有蒸汽逸出。
放置溶液2-3分鐘後,它會發出強烈的燃燒聲,並釋放出無色無味的氣體。
現在,如果你在試管口前燃燒一根火柴,你會看到淡藍色的火焰,然後聽到爆裂聲。
以下是上述實驗中涉及的反應
$$Zn + 2HCl \rightarrow ZnCl_2 + H_2\uparrow$$
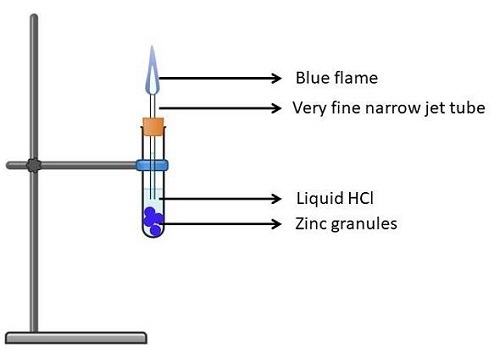
圖5:Zn對HCl酸的作用
什麼是鹼?
圖6:強鹼和弱鹼(顏色用於區分,並非基於任何科學意義)
溶於水後生成帶負電荷的氫氧根離子(OH-)的化合物稱為鹼。
例如,NaOH釋放Na+和OH-離子。
鹼的性質實驗
實驗1:石蕊試驗
取兩個試管,並將它們放在試管架上。
現在,將兩個試管分別標記為1和2。
取試管1,加入5毫升紅色石蕊試液。
現在在試管2中加入5毫升紅色石蕊試液。
現在,用滴管吸取NaOH溶液,在試管1和2中分別加入等量。
仔細觀察試管中顏色的變化。
實驗2:碳酸鈉(固體)
取一個平底燒瓶,加入1克碳酸鈉和少量蒸餾水。
現在取一個(乾燥的雙孔)軟木塞。這個軟木塞應該適合分液漏斗。此外,還應在其上安裝一個導氣管。
現在,用乾燥的雙孔軟木塞塞住平底燒瓶的瓶口。然後加入稀NaOH溶液(液態)。
不會發生任何變化,即不會發生反應。
實驗3:鋅
取一個(乾淨乾燥的)試管,放入鋅粒。
將NaOH溶液(液態)倒入試管中,使鋅粒浸沒在其中。
現在稍微傾斜試管,並用軟木塞將其塞緊。
將本生燈固定在試管上,然後點燃。
現在將試管口緊緊塞住。這應確保沒有蒸汽逸出。
放置溶液2-3分鐘後,它會發出強烈的燃燒聲,並釋放出無色無味的氣體。
現在,如果你在試管口前燃燒一根火柴,你會看到淡藍色的火焰,然後聽到爆裂聲。
以下是上述實驗中涉及的反應:
$$2NaOH + Zn \rightarrow Na_2ZnO_2 + H_2\uparrow$$
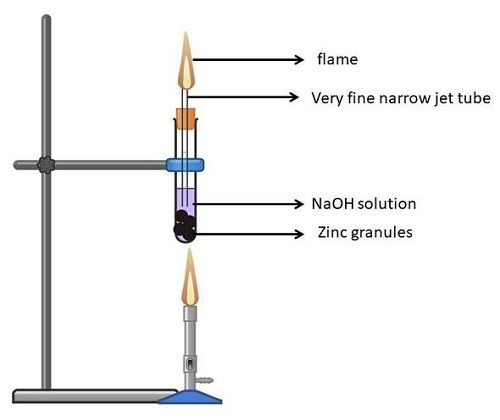
圖7:Zn對NaOH的作用
注意事項
由於大量產生的氫氣會導致爆炸,因此應確保使用少量反應物(NaOH、HCl、Zn)。
使用細噴嘴燃燒氫氣。
只有在確保裝置完全密閉後,才能將HCl加入碳酸鈉中。
處理NaOH和HCl等化學藥品時應小心,因為它們會造成傷害。
觀察結果
| 實驗 | 酸 | 鹼 |
|---|---|---|
| 實驗1:石蕊試驗 | 藍色石蕊試液與鹽酸反應後變紅。 | 紅色石蕊試液與NaOH反應後變藍。 |
| 實驗2:碳酸鈉(固體) | HCl與碳酸鈉反應釋放CO2。 | NaOH與碳酸鈉反應沒有觀察到反應。 |
| 實驗3:鋅 | HCl與鋅反應生成ZnCl2和H2氣體。 | NaOH與鋅反應生成鋅酸鈉和H2氣體。 |
結論
鹽酸與藍色石蕊試液反應實驗中,溶液變紅。類似地,與碳酸鈉反應時,會釋放CO2。此外,HCl與鋅反應會釋放ZnCl2和H2氣體。因此,證明了HCl的酸性。
類似地,NaOH與紅色石蕊試液反應會使其變藍。與碳酸鈉反應時,NaOH沒有反應。最後,NaOH與鋅反應生成鋅酸鈉和H2氣體。因此,NaOH表現出所有鹼的性質。
常見問題
Q1. 如何透過實驗鑑定酸和鹼?
A1. 有多種實驗可以鑑定酸和鹼。其中一種是石蕊試驗。使用藍色石蕊試液可以鑑定酸,使用紅色石蕊試液可以鑑定鹼。因為藍色石蕊與酸反應後變紅,紅色石蕊與鹼反應後變藍。
Q2. 酸鹼指示劑的重要性是什麼?
A2. 酸鹼指示劑在滴定實驗中用於確定反應的終點。它們也有助於測量不同化合物的pH值。此外,酸鹼指示劑還有助於在科學中進行引人入勝的變色演示。
Q3. pH值有可能為負值嗎?
A3. 儘管pH值的範圍僅為0-14,但可以計算出負的pH值。在氫離子摩爾濃度大於1N的酸中,有可能出現負的pH值。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP