電化學電池
引言
電化學電池是一種能夠從自發化學反應中產生電能的系統。讓我們進一步討論它:
手機電池在插入充電器時是如何充電的?電視遙控器中的電池又是如何工作的?在電化學這個科學領域,所有這些疑問都有答案。電化學的研究包括利用電力進行非自發化學反應以及透過化學反應產生電力。電池被用來實現這個目標。電池是導致化學反應產生電力或產生電力的元件。
什麼是電化學反應?
任何由電流流動引起或伴隨電流流動的過程,通常涉及兩種物質(一種是固體,另一種是液體)之間的電子轉移,都被認為是電化學反應。固體電極和一種物質(如電解質)相互作用發生電化學反應。透過在電極之間產生電流,這種流動導致反應釋放或吸收熱量。例如,當與彼此接觸的兩個電極觸發氧化還原(redox)反應時,反應中涉及的所有原子的氧化數都會發生變化。
電化學反應的過程
帶負電的電子的特性決定了物質如何與流經系統的電流相互作用。由於質子是帶正電的物質單位,可以在元素、原子組或分子中找到,因此電子作為電的基本單位,對其具有很強的吸引力。
粒子彼此之間的化學吸引力與這種吸引力相似。每個化學反應都會導致原子電子結構的變化,這些釋放的電子可以與物質粒子結合形成還原反應,或者被它們釋放(氧化)。法拉第定律規定了電流流動中的自由電子與其中引發反應的物質原子之間的定量關係。電化學過程的組分,通常稱為離子導體或電解質
什麼是電化學電池?
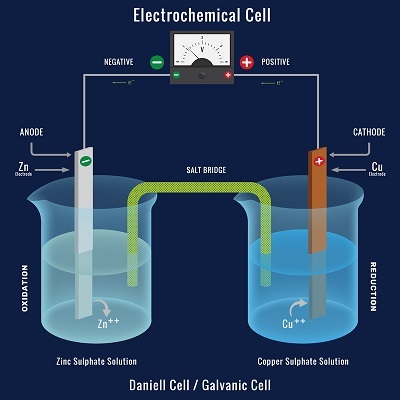
能夠從自發化學反應中產生電能的系統就是電化學電池。在這個過程中發生的化學反應是氧化還原反應。在氧化還原反應中,電子在化學物質之間轉移。它們也稱為伽伐尼電池或伏打電池。丹尼爾電池就是一個電化學電池的例子。
電化學電池的基本組成部分包括:
電解質——是在電極之間發現的一種物質,當溶解在像水這樣的極性溶劑中時,會產生自由流動的離子,從而產生導電溶液。
電極——是電化學電池中使用的固體導電體,由良好的導體(如金屬)製成。
陰極 - 電池中發生還原反應的區域。
陽極 - 電池中發生氧化反應的區域。
鹽橋 - 電化學電池的氧化和還原半電池透過鹽橋連線,完成電路。它充滿了KCl和其他飽和鹽溶液。橋樑對於溶液中的離子在半電池之間流動是必要的,這是必需的。
它們有兩種型別:
電化學電池的型別有哪些?
主要有兩種型別:
伽伐尼電池/伏打電池——在這些電化學電池中,化學能轉化為電能。
電解電池——在這些電池中,電能轉化為化學能。
解釋工作原理
工作原理
電化學系統的基本工作原理是在其中發生的氧化還原反應產生的電子轉移,從而產生電流。
工作機制
當電化學電池組裝完成後開啟開關時,在外電路的檢流計上可以看到偏轉。檢流計的指標向盛有硫酸銅溶液的燒杯方向移動。這表明電流是從硫酸銅溶液燒杯流向硫酸鋅溶液燒杯。當電路閉合時,發生變化,導致鋅電極中的鋅原子氧化,銅棒中的銅原子還原。鋅釋放兩個電子,銅透過外電路接受它們。
$$ \mathrm{總氧化還原反應:Zn(s) + Cu^{2+}(aq) \rightarrow Zn^{2+}(aq) + Cu(s)} $$
如何計算電化學電池電勢?
反應的電化學電池電勢通常被稱為電池的標準電動勢。電化學電池是基於一個可以分為兩個半反應的過程:還原半反應和氧化半反應。
還原半反應 - 透過獲得電子形成金屬。
氧化半反應 - 透過失去電子形成陽離子。
讓我們來看一下鋅和銅的例子:
$$ \mathrm{Zn(s) + Cu^{2+}(aq) \rightarrow Zn^{2+}(aq) + Cu(s)} $$
這些銅離子在陰極附近轉變為銅金屬,然後進一步沉積。公式是
$$ \mathrm{Cu^{2+} + 2e^{-} \rightarrow Cu(s)} $$
電池表示法如下:
$$ \mathrm{Zn | Zn^{2+}(aq) || Cu^{2+}(aq) | Cu} $$
電池的陰極和陽極分別位於其右側和左側。
陰極和陽極的標準電動勢之差構成電化學反應電池的標準電動勢。
公式如下:
$$ \mathrm{E^{0}_{cell} = E^{0}_{cathode} - E^{0}_{anode}} $$
如果反應發生的環境不是標準條件,則可以使用以下公式:
$$ \mathrm{E_{cell} = E^{0}_{cell} - \frac{RT}{nF}lnQ} $$
其中n表示反應中涉及的電子數,T表示溫度,F表示法拉第常數,Q表示反應商。
電化學電池的應用
在冶金學中,許多有色金屬透過電解電池進行電精煉,從而生產出非常純淨的金屬,如Pb、Zn、Al和Cu。這些金屬是使用電解電池電解提取的。
透過將其儲存在電解電池中,它被用來從熔融NaCl中回收純Na金屬。
在助聽器中使用氧化銀電池。
在海軍裝置中,熱電池用於軍事應用。
電化學反應的例子
無論何時使用水溶液。最簡單的氧化還原反應如下:
在陰極 - $ \mathrm{2H_{2}O + 2e^{-} \rightarrow H_{2} + 2OH^{-}(水被還原)} $
在陽極 - $ \mathrm{2H_{2}O \rightarrow 4H^{+} + O_{2} + 4e^{-}(水被氧化)} $
當使用活性金屬作為陽離子時,$ \mathrm{H_{2}O} $在陰極被還原。當陽離子是多原子離子時,水在陽極被氧化。
腐蝕是電化學過程的另一個很好的例子。當裸露的鐵與水分接觸時,由於電化學反應,鐵會迅速生鏽,其中水滴變成一個微小的伽伐尼電池(它氧化鐵)。
電化學應用
利用電池的概念可以製造蓄電池。電池是科學和技術中使用的裝置,它儲存化學能並以電的形式提供能量。
國防應用(熱電池)
電子攝像機(鋰電池)
音訊裝置(氧化銀電池)
電鍍用途廣泛,包括珠寶製造和保護某些金屬免受腐蝕。
電化學在許多行業中是必需的,包括氯鹼工業。
結論
電化學的研究是引人入勝的。電化學反應很重要,因為它們具有巨大的學術和實踐意義。理解這些反應有助於我們理解日常用品(如電池)的工作原理。電化學電池可以利用化學反應產生的化學能來產生電能,而電能也可以用來產生化學能。
常見問題
1. 丹尼爾電池和伏打電池有什麼區別?
根據提供的或汲取的電流,伏打電池可能是可逆的,也可能不是可逆的,而丹尼爾電池總是可逆的。
2. 哪些因素會影響電極電勢?
電極獲取電子的能力稱為還原電勢,而氧化電勢是指電極失去電子的趨勢。溫度和電極表面的金屬離子濃度決定了它的電勢。
3. 如何根據吉布斯自由能確定標準電池電勢?
在伽伐尼電池中,吉布斯自由能與電勢的關係由公式 $ \mathrm{G^{0}_{cell} = nFE^{0}_{cell}} $ 表示。如果 E°cell > 0,則反應可以發生。
4. 可以用鋅罐盛放硫酸銅溶液嗎?
銅的活性低於鋅。因此,鋅可以從其鹽溶液中置換出Cu。如果將 $ \mathrm{CuSO_{4}} $ 溶液儲存在鋅容器中,銅將從溶液中置換出來。
$$ \mathrm{Zn + CuSO_{4} \rightarrow ZnSO_{4} + Cu} $$
因此,不能用鋅罐盛放硫酸銅溶液。
5. SI系統中電動勢的測量單位是什麼?
電池每庫侖電荷所含的能量稱為電動勢 (EMF),其 SI 單位為伏特 (V),等於焦耳每庫侖。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP