化學定律
介紹
化學定律是由幾位科學家透過各自的實驗確定的。多年來,為了理解我們周圍發生的與化學領域相關的自然規律,許多定律被提出、修改和修正。然而,某些定律被認為是化學中最基本的,例如,**質量守恆定律**。其他定律,例如能量守恆定律、查理定律等等,都遵循這一定律。
什麼是理想氣體和真實氣體?
理想氣體被定義為完美的氣體,它支援建立壓力(P)、氣體量(n)、溫度(T)和體積(V)等變數之間存在的定量關係。然而,這是一種理論上的物質,其特性包括:氣體粒子非常小,似乎不佔據任何空間;運動是恆定的、隨機的以及直線運動。另一方面,真實氣體具有相當大的體積,並表現出非彈性碰撞。
玻意耳定律
根據玻意耳定律,氣體變數(例如,**體積和壓力**)之間存在著重要的關係。然而,在應用此定律時,必須保持氣體的**溫度和摩爾數**不變。該定律指出,給定質量的理想氣體所施加的絕對壓力與其在任何封閉系統中的體積成反比。該定律表示為:
$$\mathrm{P\:\varpropto\:\frac{1}{V}\:or\:,\:P\:=\:\frac{x}{V}\:or\:,\:PV\:=\:x\:,\:其中x為常數}$$
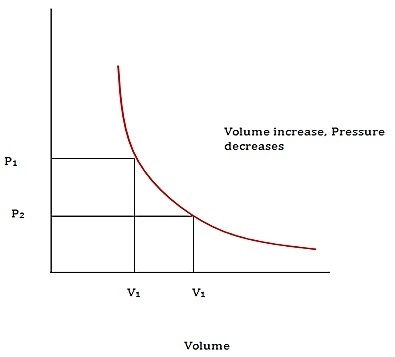
圖1 - 玻意耳定律
查理定律
著名的科學家雅克·查理髮現了確定氣體溫度和體積變數之間關係的定律。在此定律中,摩爾數和壓力保持不變。該定律指出,氣體的體積與其溫度成正比。該定律表示為:
$$\mathrm{V\:\varpropto\:T\:or\:,\:V\:=\:yT\:其中y為常數}$$
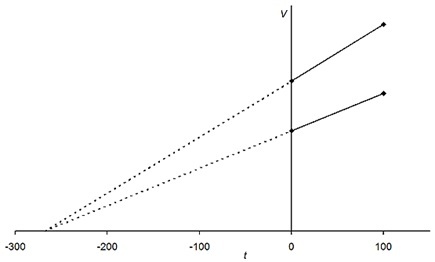
圖2:查理定律
阿伏加德羅定律
阿伏加德羅定律主要解決了與蓋-呂薩克定律相關的問題。在此定律中,阿伏加德羅指出,在**相同溫度和壓力**下,不同氣體的等體積包含相同數量的分子。該定律的數學表示為:
$$\mathrm{V\varpropto\:n\:or\:,\:V\:=\:zn\:,\:其中z為常數}$$
這裡,氣體體積之間的關係與其分子數成正比。
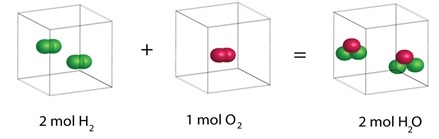
圖3 - 阿伏加德羅定律
知識共享署名-相同方式共享4.0,公共領域,來自維基共享資源
理想氣體狀態方程
理想氣體狀態方程綜合了三個簡單的氣體定律,並根據氣體的體積表示。該定律似乎與所述氣體的體積成正比和反比。表示為:
$$\mathrm{V\:\varpropto\:\frac{nT}{P}\:or\:V\:=\:R\frac{nT}{P}\:or\:,\:V\:=\:\frac{nRT}{P}\:or\:,\:PV\:=\:nRT}$$
這裡,R是通用氣體常數,n表示分子數,P表示理想氣體的絕對壓力,T表示絕對溫度,V表示氣體體積。
質量守恆定律
質量守恆定律被認為是化學領域的基本定律,它指出質量既不能被創造也不能被消滅,而只是從一種形式轉化為另一種形式。
能量守恆定律
能量守恆定律被定義為一個與周圍環境隔離的系統,系統的總能量守恆。
結論
在本教程中,主要關注的是確定化學定律,這些定律傾向於建立自然界同時發生的許多現象。然而,討論的某些定律如下:能量守恆定律、質量守恆定律表明它們之間存在著複雜的關係。然而,諸如玻意耳定律、查理定律等等定律表明氣體變數之間存在著確定的關係。
常見問題解答
1. 熱力學定律是什麼?
為了定義表徵處於熱力學平衡點的熱力學系統的基本物理量,主要有四個熱力學定律被認為是至關重要的。這四個定律分別是:**熱力學第零定律、第一定律、第二定律和第三定律**。
2. 法拉第定律是什麼?
法拉第定律處理的是導線線圈周圍磁場環境的變化,從而導致線圈中產生感應電動勢(emf)。然而,需要理解的是,電壓的產生並不取決於變化發生的方式。該定律進一步指出,從電極釋放的淨物質與透過的淨電量成正比。
3. 化學領域中最基本的定律是什麼?
根據化學領域中所述的定律,質量守恆定律被認為是最基本的定律,因為該定律是關於在任何化學反應中物質的量保持不變。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP