原子核的大小
引言
在物理學領域,識別基本結構對於研究原子核至關重要。然而,如果沒有盧瑟福進行金箔實驗來理解原子的結構,原子核的結構就不會為世人所知。值得注意的是,早些時候,原子的結構被認為是湯姆遜提出的“梅子布丁模型”。在這個模型中,人們認為布丁帶有正電荷物質,而梅子代表負電荷的分佈。
原子核的定義
在盧瑟福用氦原子進行金箔實驗後,人們得出結論:原子核是一個相對較小、密度較大的區域,包含質子和中子 (Khetselius *et al*. 2018)。
質子和中子位於原子的中心。然而,在發現之後,人們構建了幾個模型,詳細地表明原子核由中子和質子組成,並被被稱為電子的帶負電粒子的雲包圍。
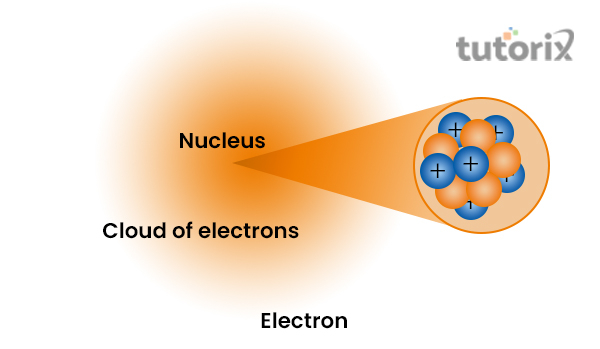
圖1:原子核的結構
與原子核相關的歷史
通常被稱為原子核的原子核一詞來源於拉丁語單詞“nucleus”,並與另一個單詞“nux”相關,意思是堅果或核。然而,這個詞是由邁克爾·法拉第提出的,用於描述原子的中心。J.J.湯姆遜在陰極射線管實驗的支援下發現原子包含帶負電的粒子 (Vigen, 2018)。
湯姆遜的梅子布丁模型指出原子同時具有帶正電和帶負電的粒子。最終,盧瑟福的發現確立了原子的真實結構。
原子核的特徵
人們注意到幾個特徵,例如,在原子核中,帶正電的粒子——質子,質子的數量決定了特定元素的原子概念。中子的數量決定了原子所具有的同位素型別 (Geeksforgeeks.org, 2022)。
質子和中子的重量都比微小的電子粒子大。因此,這表明原子核的質量集中在原子核周圍 (Schoolscience.co.uk, 2022)。
此外,人們注意到原子核內的質子和中子之間存在強大的電力。由於原子核周圍存在正電荷,電子粒子會被吸引到原子核。
盧瑟福的金箔實驗
盧瑟福想要展示電子在原子內的排列,這導致他進行了金箔實驗,該實驗展示了α粒子(ɑ)的快速運動特性。使用帶雙電荷的氦離子來表示α粒子,使用金箔是因為它可以製成薄而細的薄層 (Spark.iop.org, 2022)。
然而,ɑ粒子的質量大於質子,因為他認為只會發生輕微的偏轉。
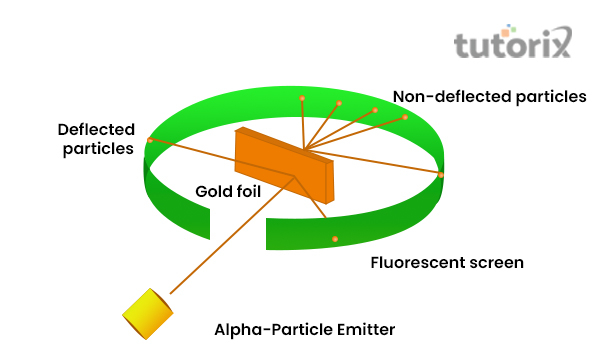
圖2:盧瑟福的金箔實驗
盧瑟福的觀察和結論
透過他的觀察,人們注意到大多數α粒子直接穿過而沒有發生任何偏轉,而一些α粒子以一定角度發生偏轉。此外,人們還注意到一些α粒子反彈 (Chem.libretexts.org, 2022)。
由此可以得出結論:原子的中心包含正電荷,原子的質量集中在原子的中間區域。電子存在於它們圍繞原子核的特定軌道中。此外,人們注意到原子核的大小比原子的大小相對較小。
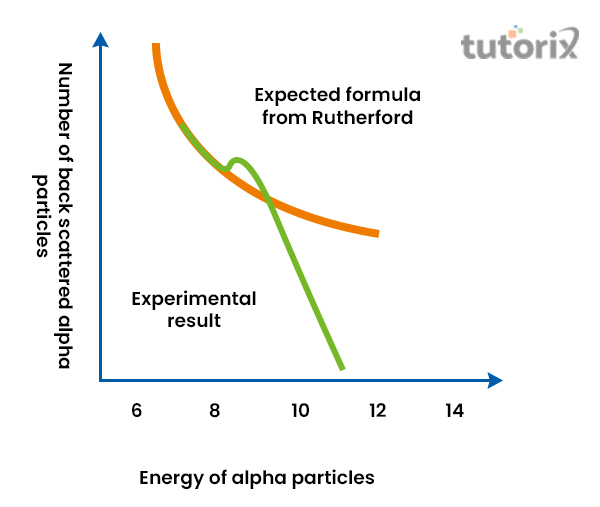
圖3:盧瑟福公式和偏差
原子核的大小和密度
從盧瑟福的金箔實驗中,人們注意到原子核的大小比原子的尺寸相對較小。例如,氫原子的尺寸比原子核的尺寸大145,000倍。由於存在單個原子,原子核的尺寸為1.75 * 10-15 m (Spark.iop.org, 2022)。然而,用於測量原子核尺寸的公式可以表示為:𝑅 = 𝑅0𝐴1/3,其中,𝑅0 = 1.2 * 10-15 m。
結論
在本教程的總結性思考中,我們理解到原子的結構對於定義原子核的大小很重要。從盧瑟福的金箔實驗中,人們注意到原子具有特定的結構,其中原子核位於中間,電子在其周圍的特定軌道上旋轉。對於許多原子,人們注意到原子核的大小相對小於原子的尺寸。
常見問題
Q1. 盧瑟福實驗中使用金箔的原因是什麼?
A1:盧瑟福在實驗中使用金箔是因為金箔比用作盧瑟福射線散射實驗一部分的其他材料具有更高的延展性。然而,使用了相對較薄的箔片,因此它們有助於形成非常薄的薄膜。
Q2. 盧瑟福實驗中α粒子偏轉的原因是什麼?
A2:根據實驗,盧瑟福認為α粒子將直接穿過箔片。然而,實驗表明,α粒子在穿過箔片時路徑會發生輕微偏轉。其原因是由於粒子內部存在的電荷彼此排斥。
Q3. 我們從盧瑟福的金箔實驗中學到了什麼?
A3:我們從盧瑟福的金箔實驗中瞭解到與原子相關的幾個重要事實。從這個實驗中,我們知道原子只是空的空間,中心有一個相對較小的原子核,並帶正電荷。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統 (RDBMS)
關係型資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP