原子半徑的週期性趨勢
引言
瞭解原子半徑有助於我們預測原子的反應活性水平。半徑越小,反應活性就越強。本文涵蓋了化學元素原子半徑的所有方面。下面將討論元素週期表中的規律、不同型別的半徑等等。
定義原子半徑和原子大小
元素週期表是一個有組織的參考表格。它包含按原子序數從小到大排列在不同族中的元素。分子核心中的質子數量就是原子序數。原子半徑定義為在孤立條件下,從原子核到原子外層電子殼層中最外層電子的距離的測量值。元素週期表中,從左到右,原子序數逐漸增加。但是,元素週期表中從左到右原子大小減小。從上到下,原子序數和原子大小都增加。請參考下圖。
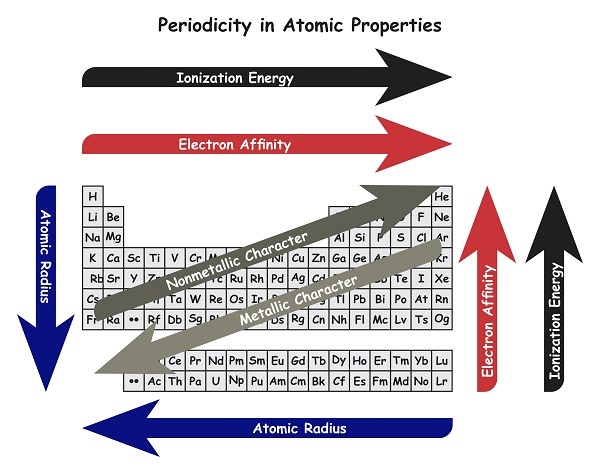
什麼是半徑和原子半徑?
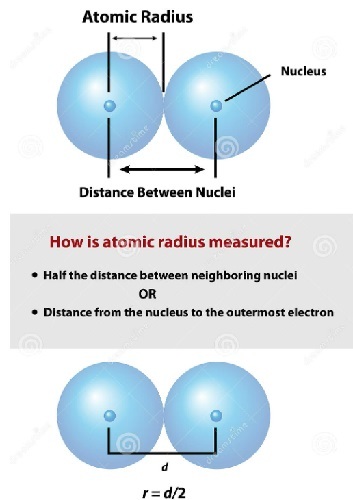
首先,半徑這個術語與幾何圖形圓有關。其次,原子半徑的特徵是將原子的外觀近似為球體。球體是三維投影的圓。圓的半徑是如何定義的,原子半徑的定義又有什麼不同呢?
直徑是圓上兩點之間穿過圓心的線段,半徑是直徑的一半。原子包含不同形狀的電子殼層,一個套著一個,因此原子的半徑是用最外層電子殼層中的孤立電子來測量的,如下圖所示。因此,從原子核中心到原子外層電子殼層的距離稱為原子半徑。
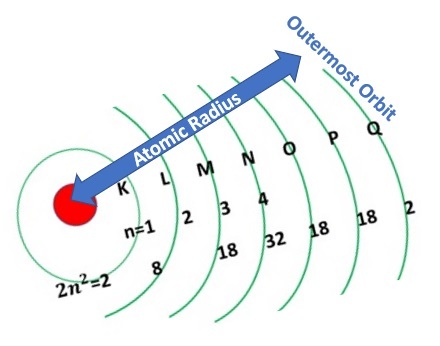
半徑型別
存在許多流行的原子半徑概念。如前所述,由於可用資訊有限,很難精確預測原子的形狀和結構。用圓或球體來近似是一種方法。讓我們在下文中詳細瞭解這些概念。
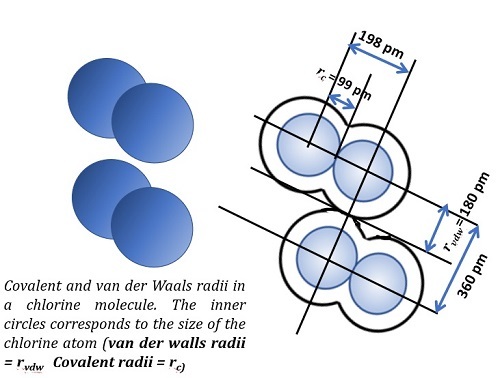
範德華半徑
這個概念定義為兩個處於非鍵合狀態的相鄰原子核之間的距離。請看下圖中這兩個非鍵合的原子是如何鍵合到化合物分子中的。
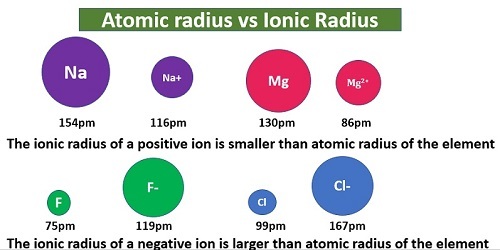
離子半徑
離子鍵是一種電價鍵,其中兩個帶相反電荷的離子相互吸引形成鍵。這種鍵並非存在於元素態,而存在於化合物態。正離子和負離子原子核之間的距離被認為是離子半徑的兩倍。
共價半徑
在共價鍵的情況下,原子半徑的概念保持不變,只是化合物的形成是透過共享電子實現的。
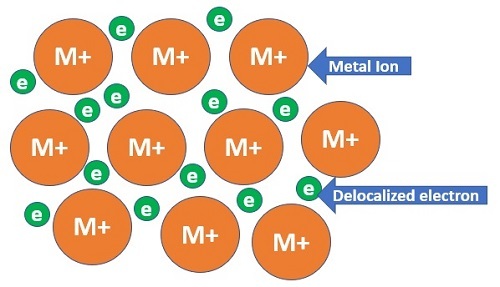
金屬半徑
這裡,金屬簇是區分元素的關鍵。其餘都保持不變。金屬簇中原子之間的結合與透過連線相反極性離子形成的離子鍵或透過共享電子形成的共價鍵完全不同。在金屬鍵閤中,正離子的密集結構共享鬆散分佈的電子。因此,金屬半徑是兩個金屬離子鍵長的一半。
原子大小和原子半徑的區別
原子大小是原子的尺寸。利用半徑的測量值,我們可以理解原子的大小。有四種計算半徑的方法。因此,讓我們公平地瞭解這四種方法之間的區別,並將它們與原子大小聯絡起來。
| 序號 | 半徑測量因素 | 範德華 | 離子 | 共價 | 金屬 |
|---|---|---|---|---|---|
| 1 | 用鍵合原子還是非鍵合原子進行測量? | 非鍵合 | 鍵合 | 鍵合 | 鍵合的正離子 |
| 2 | 鍵合型別 | 原子間的弱力 | 正離子和負離子之間的吸引力 | 透過共享價電子進行鍵合 | 透過金屬正離子簇和自由電子進行鍵合 |
| 3 | 鍵長 | 兩個非鍵合原子之間 | 離子化合物中的兩個原子之間 | 共價化合物中的兩個原子之間 | 金屬正離子簇的兩個原子之間 |
| 4 | 半徑 | 鍵長的一半 | 鍵長的一半 | 鍵長的一半 | 鍵長的一半 |
表1:計算半徑的四種方法的比較
結論
討論了與圓相關的原子半徑和半徑的一般概念。詳細解釋了不同型別的半徑概念。原子大小與元素原子本身比與其作為化合物的存在更相關。共價半徑或離子半徑是兩個相鄰原子核之間平均距離。原子大小或多或少與上述相同,只是它是元素原子的半徑。例如,如果可能存在半徑為X埃的正離子(1埃=10-10米),並且相同元素的負離子半徑為Y埃,則必須按原樣表示為原子大小,而不是對兩個值取平均值表示為原子半徑。
常見問題
Q1. 原子大小或半徑是用哪些不同的單位表示的?
A1. 埃(1埃=10-10米)和皮米(1皮米=10-12米)是用於表示原子半徑和大小測量的兩個單位。
Q2. 什麼是玻爾半徑?為什麼它不被認為是一種半徑?
A2. 玻爾半徑僅適用於只有一個電子的原子,如氫和氦。尼爾斯·玻爾精確地找到了氫原子的這個測量值,它是一個常數,為5.29177 x 10-11米。
Q3. 即使使用高精度儀器,為什麼原子半徑測量仍然如此複雜?
A3. 根據海森堡不確定性原理,電子不會永久停留在其軌道上。因此,很難找到半徑,因此測量的是化合物中兩個鍵合原子核之間的距離。
Q4. 哪個元素具有最大的原子半徑?
A4. 鍅 (Fr) - 260 pm
Q5. 哪個元素具有最小的原子半徑?
A5. 氦 (He) - 31 pm


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP