(a) 說明碳既不能形成C4+ 陽離子,也不能形成C4– 陰離子,而是形成共價鍵的原因。此外,說明共價化合物(i) 導電性差。(ii) 熔點和沸點低的原因。(b) 寫出苯(C6H6)的結構式。
(a) 碳不能形成C4+ 陽離子,因為 失去 4 個電子需要大量的能量。
碳不能形成C4- 陰離子,因為它 對於其具有 6 個質子的原子核來說,很難容納 10 個電子。
因此,碳原子 共享電子並形成共價化合物。
(i) 共價化合物不離解成離子,因此不能導電。
(ii) 碳原子之間的分子間作用力較弱。因此,它們的熔點和沸點較低。
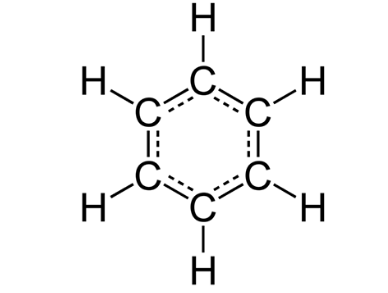
(b) 苯(C6H6)的結構式。

廣告

 資料結構
資料結構 網路
網路 關係資料庫管理系統
關係資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP