現代元素週期表中的電子親和能
簡介
當一箇中性的孤立的氣態原子吸收一個e⁻形成帶負電荷的陰離子時釋放或吸收的能量稱為電子親和能。當e⁻與孤立的氣態原子結合時,可能會產生或吸收能量,這取決於過程是放熱還是吸熱。混合過程中釋放的能量越大,電子親和能越大,表示為ΔHeg。
$$\mathrm{X(g)\:+\:e^{-}\rightarrow\:X^{-}(g)}$$
通常,發生放熱過程,導致電子親和能為負值。鹵素只需要一個電子就能達到惰性氣體構型,因此它們具有很大的負電子親和能,而惰性氣體則具有很大的正e⁻親和能。
什麼是元素的電子親和能?
它是當一個e⁻被提供給一個孤立的氣態原子時釋放的能量。e⁻親和能以KJ/mol或每個原子的e⁻伏特表示。根據組成成分,反應可以是放熱或吸熱的。
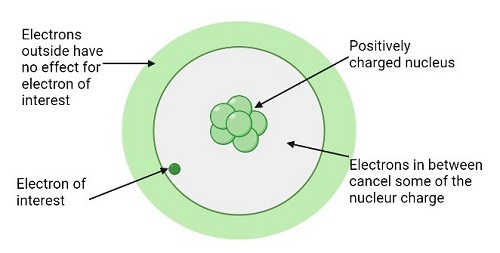
當一個e⁻被引入到一個已經獲得一個e⁻並且已經達到穩定的惰性氣體構型的氣態原子中,或者當電子被引入到惰性氣體中時,需要大量的額外能量來克服軌道中已存在電子引起的排斥力。因此,在這種情況下,電子親和能變得非常正。鹵素具有很大的負電子親和能。這兩個例子說明,在惰性氣體之前,週期表右上方將有很大的負值。
影響電子親和能的因素
核電荷
當總負電荷增加時,隨著額外電子的加入,吸引力也會增加。此外,當核的大小增加時,焓變得更負。
原子量
隨著原子尺寸的增加,最外層電子與原子核之間的距離也增加。因此,新e⁻與核之間的吸引力減弱。因此,它變得不那麼負了。
電子構型
只有部分或完全填充軌道的元素才具有更高的穩定性。當能量施加到某些元素時,電子會被新增到它們中。因此,它們的e⁻親和能值較高。
週期中的電子親和能
隨著時間的推移,從左側到右側穿過週期,元素的原子尺寸減小,而有效核電荷增加。因此,核與額外e⁻之間的吸引力增加。因此,隨著週期從左側到右側的進行,電子親和能變得更負。
族中的電子親和能
隨著e⁻在族中向下移動,它變得不那麼負。這是因為原子尺寸和核電荷都增加,但原子尺寸的影響大於核電荷。因此,核與額外e⁻之間的吸引力減小,焓變得不那麼負。
電子親和力的測量和用途
由於它們的能級可以透過與固態或液態中的其他原子或分子相互作用而發生變化,因此此屬性僅用於識別氣態中的原子和分子。Robert S. Mulliken 根據電子親和力列表設計了一個原子的電負性標度,它類似於電子親和力和電離勢的總和。涉及e⁻親和力的另外兩個理論概念是電子化學勢和化學硬度。另一個例子是,e⁻受體是比另一個分子或原子具有更高正電子親和力的分子或原子。e⁻供體是具有較低正值的人。當它們聚集在一起時,可能會發生電荷轉移過程。
單電子還原
單個e⁻原子從供體化學物質轉移到有機物質。它區分了像氫化物轉移過程這樣的兩個e⁻有機還原。自由基陰離子通常作為1e⁻還原的第一個步驟形成,然後參與後續反應。Birch 還原中的次要過程是醇的質子消除。這也被稱為溶解金屬還原過程。在液氨或鈉體系中,炔烴還原為烯烴的工作原理類似。初始自由基陰離子中間體提取氨的質子並將其轉移到自由基上。為了生成陰離子,需要進行第二個e⁻轉移,它還從中性烯烴中獲取質子。
結論
當一個e⁻被引入到一個孤立的氣態體系時釋放的能量稱為電子親和能。電子親和能的單位是KJ/mol。元素的電子親和能由其核電荷、原子半徑和電子構型決定。當在族中向下移動時,e⁻親和能變得不那麼負。在週期中從左側移動到右側,電子親和能變得更負。鹵素具有很大的負電子親和能,因為它們可以接受一個e⁻以達到惰性氣體的電子構型。惰性氣體具有正電子親和能。
常見問題
1. 確定並解釋電子親和能最低和最高(S、P、F、Cl)的化合物?
當我們沿著週期從左到右移動時,電子親和能變得更負。當我們在族中向下移動時,它也變得不那麼負了。當一個e⁻被引入到2p軌道時,它比被引入到3p軌道時排斥力更強。因此,磷的電子親和能最低,而氯的電子親和能最高。
2. 哪種元素具有最大的電子親和能?
氯具有最大的e⁻親和能。
3. 哪種元素具有最低的電子親和能?
汞具有最低的e⁻親和能。
4. 電子親和力和電子親和能之間有什麼區別?
e⁻親和能和e⁻親和力的主要區別在於,當一個孤立的氣態原子獲得一個電子時釋放的能量稱為電子親和能,而電子親和力表示原子接受電子的趨勢。
5. 區分電負性和電子親和能?
電負性和e⁻親和力的主要區別在於,電負性是原子吸引化學化合物中共享電子對的趨勢以形成共價鍵,而e⁻親和能是在一個e⁻被引入到一個孤立的氣態分子時釋放的能量。此外,雖然電子親和能可以定量評估,但電負性不能,因為它是一種定性概念。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP