濃差電池
介紹
濃差電池是一種原電池,其兩個半電池包含電解質非常相似,但濃度不同。它與電極一起使用。當達到化學平衡時,這種電池會產生微小的電壓差。這是透過將電子從低濃度半電池移動到高濃度半電池來實現的。由於濃差電池的電極相同,其標準電極電位為0。但是,由於離子濃度的差異,兩個半電池之間可能存在電位差。可以使用能斯特方程計算此電壓差。
什麼是濃差電池?
濃差電池由電解池和由兩個半電池組成的電化學電池組成。每個半電池都包含相同的電極,但它們的濃度不同。高濃度半電池會稀釋,而低濃度半電池的濃度會透過這兩個半電池之間的電子轉移而提高。當電池的總目標是達到化學平衡時,這一過程就會完成。例如,比較兩個用鹽橋連線的具有相同電解質的溶液。當兩個相同的金屬片分別浸入這兩個溶液中時,整個裝置就會作為一個原電池工作。
解釋濃差電池的工作原理
濃差電池由兩個具有相同電極但電解質濃度不同的半電池組成。這種濃差電池的工作原理取決於維持兩個電池濃度之間的平衡。它相應地濃縮更稀的溶液。透過轉移電子,它實現了兩個半電池之間的平衡。電子將從低濃度半電池轉移到高濃度半電池。電池的電動勢可以按如下方式計算:
$$\mathrm{E^{0}_{cell}\:=\:E^{0}_{cathode}\:-\:E^{0}_{anode}}$$
一旦電池達到平衡,它產生的電壓可以使用能斯特方程計算如下:
$$\mathrm{E^{0}_{cell}\:=\:E^{0}_{cell}\:-\:\frac{0.0592}{n}\log\:Q}$$
其中
$E^{0}$ 是電池的標準還原電位。
n 表示交換的電子數。
Q 表示反應商。
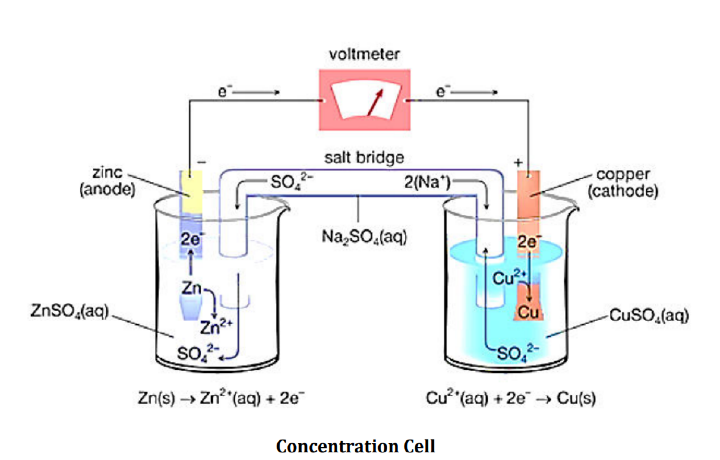
本實驗使用兩個盛有CuSO4和ZnSO4電解質溶液的燒杯。它們透過裝有氯化鉀(KCl)水溶液的鹽橋連線。為了測量電勢,將Zn和Cu電極分別浸入其相應的電解質中,並透過電壓表連線。Zn通常作為陽極,容易發生氧化並帶負電。電子透過鹽橋傳遞,並在Cu陰極處還原。結果,陰極帶正電。這種從陽極到陰極的電子轉移導致電流反向流動,電壓表會測量到。鹽橋連線兩個半電池,並保持它們的電中性。不能使用導線連線兩個電池,因為它會與從一個端子流向另一個端子的離子反應。由於左側濃度較低,右側濃度較高,電子從左向右移動。
濃差電池的型別
電極濃差電池 - 這些電池中的電位差是透過將兩個不同濃度的電極浸入相同的電解質溶液中獲得的。例如,這種電池由兩個具有不同氣體壓力的氫電極在相同的H+離子溶液中組成。
電解質濃差電池 - 這些電池中的電極相同,但它們浸在濃度不同的相同電解質中。電解質從高濃度溶液擴散到低濃度溶液的趨勢是電池內電能的來源。隨著時間的推移,兩個濃度開始趨於相等。因此,電池的電動勢最初最大,然後逐漸降至0。
解釋每種型別濃差電池的差異
| 電解質濃差電池 | 電極濃差電池 |
|---|---|
| 它主要由浸在電解質溶液中的相同電極組成。 | 這些電池由兩個相同的溶液組成。對於每個半電池,這些液體都用作電解質。 |
| 這些溶液中的電解質濃度不同,並傾向於從高濃度溶液流向低濃度溶液。 | 由於電極由相同的物質構成,因此半電池之間電極的濃度不同。 |
| $\mathrm{E_{cell}\:=\:\frac{0.0591}{n}\:\log\:\frac{c_{1}}{c_{2}}}$ | $\mathrm{E_{cell}\:=0.02955\log\:\frac{P_{i}}{P_{z}}}$ |
濃差電池的組成部分
鹽橋 - 鹽橋旨在提供離子交換的通道,同時為兩個半電池的解離提供良好的溶液。其中的電線會與透過它們的離子發生反應。在某些情況下,缺乏鹽橋會導致一個半電池中電子積聚,因為來自另一個半電池的電子流入。
電極 - 每個濃差電池都配備兩個電極。這兩個電極被稱為陰極和陽極。陽極開始失去電子,也是發生氧化的區域,而陰極則獲得電子,或發生還原的區域。
電壓表 - 電壓表用於測量濃差電池中的電池電壓。電池電勢通常稱為電動勢(emf)。這主要是由電子的運動引起的。在許多情況下,電壓表位於兩個半電池之間。產生的值可以是正值或負值,取決於電子運動的方向。然後,電壓以伏特/毫伏獲得。
結論
原電池陽極的活性組分與陰極的活性組分不同。由於電池電動勢隨濃度變化而變化,因此可以使用在兩個半電池中具有相同物質但濃度不同的物質來構建原電池。濃差電池是一種僅依賴於濃度變化產生的電動勢的電池。而原電池是一種電化學電池,它透過化學過程將化學能轉化為電能來發電,而電解池則不能。然而,通常使用電流來推動化學反應,將電能轉化為化學能。
常見問題
1. 濃度是否影響電解池?
當酸的電解質濃度在陰極和陽極處較高時,由於濃度差異而產生的擴散現象就會出現,並且電解效能會提高。
2. 濃度對電極電位有什麼影響?
當溶液中離子的比例相對於金屬發生變化時,金屬的電極電位會發生變化。電極的還原電位與正離子的濃度成正比。
3. 如何在電鍍過程中保持電解質濃度不變?
溶液中銅離子的濃度是穩定的。這是因為電鍍過程將金屬從電池的陽極移動到陰極。
4. 化學電池和濃差電池的區別是什麼?
濃差電池中兩個半電池的組成部分是相同的,但在化學電池中,組成部分可能不同。濃差電池是一種電化學電池。
5. 濃差電池的意義是什麼?
pH計是一種濃差電池,可用於測定溶液的pH值以及酸度或鹼度。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP