溶液的濃度及計算
濃度是一個在化學以及其他相關學科中廣泛使用的術語。它是一種測量一種物質與另一種物質混合量的的方法。這可能與任何形式的化學反應有關;但是,它特別用於溶液的框架中,以描述溶質在溶劑中分散的量。溶液的濃度決定了在給定量的溶液中溶解的溶質的量。它確實是一個宏觀特性,可以用定性和定量的方式表示。為了定性地表示濃度,溶液將被歸類為稀釋和濃縮。為了半定量地指示濃度,溶液可以被歸類為飽和溶液和不飽和溶液。
什麼是溶液的濃度?
溶液的濃度似乎是指特定數量的溶劑中所含溶質的量。稀溶液包含少量的溶質,而濃溶液包含大量的溶質。水溶液由兩種成分組成:溶質和溶劑。當涉及溶液濃度時,這兩者是需要認識的兩個非常重要的概念。還應該考慮這種溶液中溶質的量。
$$\mathrm{溶液濃度\:=\:\frac{溶質重量(克)}{體積(升)}}$$
表示溶液濃度的方法
百萬分率 (PPM) - 它被描述為溶液的百萬分率單位 (106 ) 中的組分的百萬分率。如果溶質以少量存在,通常會採用這種方法。
質量百分比 (W/W) - 它被測量為 100 克溶液中的溶質濃度。該陳述描述了溶液中一種物質的量,表示為其總質量的百分比。
體積百分比 (V/V) - 它被描述為 100 毫升溶液中的溶質體積。
質量體積百分比 (W/V) - 它透過 100 毫升溶液中所含溶質的量來測量。
摩爾濃度 (M) - 溶液的摩爾濃度被測量為每升溶液中溶質的摩爾數。
摩爾濃度 (m) - 溶液的摩爾濃度被測量為每千克溶劑中存在的溶質的摩爾數。
當量濃度 (N) - 它通常被稱為當量濃度,因此被描述為每升溶液中的克當量重量。它主要用於識別溶液中或滴定反應過程中反應性物質,以及在需要酸鹼化學的條件下。
摩爾分數 (X) - 它是溶質的摩爾數除以溶質和溶劑的總摩爾數
$$\mathrm{PPM\:=\:\frac{溶質質量}{溶液總質量}\:\times\:10^{6}}$$
$$\mathrm{重量百分比\:=\:\frac{溶質質量}{溶液總質量}\:\times\:100}$$
$$\mathrm{體積百分比\:=\:\frac{溶質體積}{溶液總體積}\:\times\:100}$$
$$\mathrm{質量/體積百分比\:=\:\frac{溶質質量(克)}{溶液體積(升)}\:\times\:100}$$
$$\mathrm{M\:=\:\frac{溶質質量}{溶液體積(升)}}$$
$$\mathrm{m\:=\:\frac{溶劑質量}{溶劑質量(千克)}}$$
$$\mathrm{N\:=\:\frac{溶質重量(克)}{當量質量\:\times\:體積(升)}}$$
$$\mathrm{X\:=\:\frac{溶質摩爾數}{所有組分的總摩爾數}}$$
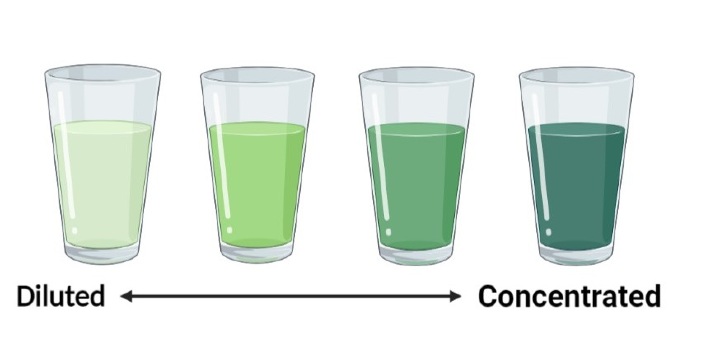
使用濃縮和稀釋來描述溶液的相對濃度
濃溶液中存在大量分散的溶質,而稀溶液似乎含有少量分散的溶質。然而,這些短語非常相似,因此我們需要能夠以非常準確的定量方式來處理濃度。儘管如此,濃縮和稀釋這兩個術語在比較一個溶液與另一個溶液時仍然很有用。當你加熱溶液時,通常會導致溶劑蒸發,你會將它濃縮,直到溶質與溶劑的比例增加。當你向這種水溶液中加入額外的水時,它會稀釋,因為溶質與溶劑的比例會降低。
確定離子的當量
濃度在醫療保健系統中至關重要,因為它以多種不同的方式使用。利用任何數量的單位對於確保正確的藥物劑量以及記錄血液中化學物質的水平也至關重要。當量是另一種考慮濃度的方法,包括在靜脈注射溶液和血液中。在這樣的離子中,1 當量等於 1 摩爾的電荷。無論電荷如何,當量的總值始終為正。例如,𝑁𝑎+ 和 𝐶𝑙− 每個都有一個當量/摩爾。
| 離子 | 當量 |
|---|---|
| $\mathrm{Na^{+}}$ | 1 |
| $\mathrm{NO^{-}_{3}}$ | 1 |
| $\mathrm{Al_{3+}}$ | 3 |
| $\mathrm{SO^{2-}_{4}}$ | 2 |
| $\mathrm{Mg^{2+}}$ | 2 |
| $\mathrm{Cl^{-}}$ | 1 |
由於這些離子的濃度比溶質的識別更重要,因此需要當量。例如,典型的靜脈注射溶液並不包含與血液中相對相同的溶質,而是電荷濃度相同。當濃度降低時,毫當量 (𝑚𝐸𝑞) 可能是更合適的單位。毫,與基本單位相同的公制字首,通常用於改變當量,因此 1 $\mathrm{1\:Eq\:=\:1000\:mEq}$ 。
結論
在化學溶液中,濃度指定了多少溶質通常分散在溶劑中。溶液是兩種或多種物質的混合物。這些化學物質通常被稱為溶劑和溶質。似乎以少量存在的成分被稱為溶質,而大量存在的成分可以定義為溶劑。溶液的濃度實際上是溶質的量與溶劑中溶質分散量的比率。溶液可以是濃縮的,也可以是稀釋的。研究人員經常被要求確定未知溶液的濃度。有各種濃度單位。摩爾分數、質量百分比、體積百分比、摩爾濃度、摩爾濃度以及當量濃度是最常用的單位。
常見問題
1. 什麼是濃度計算?
使用分散組分的指定摩爾質量和溶液密度,濃度計算器將摩爾濃度轉換為百分比濃度(反之亦然)。
2. 為什麼溶液濃度會產生影響?
溶質的濃度對於研究化學反應至關重要,因為它控制著分子在溶液中相互作用的頻率,這間接控制著反應速率和平衡引數。
3. 為什麼濃溶液不能長時間加熱?
濃溶液比其他型別的溶液更有效。如果長時間加熱,顆粒可能會獲得強度並變得非常濃縮,使其難以控制。
4. 溶液濃度在日常生活中是如何應用的?
在日常生活中,你經常會遇到溶液。例如,假設你將 1 茶匙鹽放入 2 杯水中。鹽會溶解在水中,形成溶液。
5. 根據濃度,有哪些不同型別的溶液?
根據溶質含量,你的身體可以產生 3 種形式的溶液——等滲、低滲和高滲。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP