玻恩-哈伯迴圈
引言
評估反應能量的一種方法是玻恩-哈伯迴圈。它由兩位德國化學家弗裡茨·哈伯和馬克斯·玻恩於1919年建立,並以他們命名。它闡明並有助於理解離子化合物的形成方式。因為它無法直接測量晶格能,所以主要用於計算晶格能。玻恩-哈伯迴圈是將赫斯定律應用於離子分子形成過程中發生的標準焓變的方法。焓變是描述離子化合物晶格能的熱力學量。
影響晶格能的因素
晶格能受以下因素影響:
晶體中的離子間距離,即當離子靠得更近時,它們之間的吸引力更強;以及
離子的電荷。
晶格能越大,離子靠得越近,它們的電荷越大。由於難以透過實驗直接測定晶格能,我們採用了一種稱為玻恩-哈伯迴圈的間接方法來獲得晶格能。
構建玻恩-哈伯迴圈
玻恩-哈伯迴圈包含以下步驟:
(a) 必要時,將固態/液態反應物轉化為氣態。
(b) 氣態陰離子和氣態陽離子的形成。
c) 透過結合氣態離子形成離子固體。讓我們考慮MX(一種離子固體)的生成,其中M是鹼金屬,X是氣態鹵素。
$$\mathrm{M(s)+\frac{1}{2}X_2(g)\xrightarrow{\Delta H_f} MX (s)}$$
其中 $\mathrm{\Delta H_f}$ = MX 的形成焓
上述步驟可以進一步解釋如下:
因為鹼金屬是固體,第一步是利用昇華能 $\mathrm{(\Delta H_{sub})}$ 將1摩爾金屬鹼金屬(M)轉化為氣態形式。
$$\mathrm{M^+(s)\xrightarrow{\Delta H_{sub}}M (g)}$$
這是一個吸熱反應;因此其值為正。
鹵素通常以雙原子形式存在。另外,請注意,將1摩爾氣態鹵素分子解離為氣態原子需要解離能 $\mathrm{(\Delta H_{diss})}$
$$\mathrm{X_2(g)\xrightarrow{\Delta H_{diss}}2X (g)}$$
這是一個吸熱過程,因此賦予它的值為正。
電離能 (IE) 將1摩爾氣態鹼金屬原子轉化為氣態陽離子。
$$\mathrm{M(g)\xrightarrow{IE}M^+(g)}$$
這也是一個吸熱過程,其值為正。
透過釋放稱為電子親和能 (EA) 的能量,將1摩爾氣態鹵素原子轉化為氣態陰離子。
$$\mathrm{X(g)\xrightarrow{-EA}X^-(g)}$$
因此,這是一個放熱反應,其值計算為負數。
1摩爾氣態金屬離子(陽離子和陰離子)結合形成1摩爾金屬鹵化物晶體,在此過程中釋放大量能量,稱為晶格能 (U)。
$$\mathrm{M^+(g)+X^-(g)\xrightarrow{-U}MX(S)}$$
根據赫斯定律,鹼金屬鹵化物的形成焓被認為是所有過程的總和。
$$\mathrm{\Delta H_f\:=\:\Delta H_{sub}+\frac{1}{2}\Delta H_{diss}+IE-EA-U}$$
因此,可以使用其他能量項的值來確定離子晶體的晶格能。
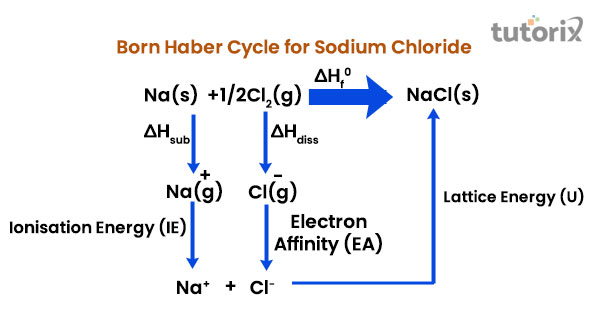
圖:氯化鈉的玻恩-哈伯迴圈
晶格能值的應用
在本節中,我們將看到晶格能值被用來描述離子固體晶體的特性。
離子固體在各種溶劑中的溶解度
離子固體的溶解度取決於兩個因素:
晶格能,它緊密地結合著離子固體的組成離子;
溶劑化能,當離子固體解離時,離子與溶劑相互作用形成溶劑化離子,這是釋放的能量。當水用作溶劑時,會生成水合離子,在這種情況下,溶劑化能被稱為水合能。
晶格能的量級越大,離子固體越不可能解離成組成離子,但溶劑化能的量級越大,離子越有可能被溶劑化。這表明上述兩種力是相反的。
因此,如果溶劑化能的量級大於晶格能,則固體將溶解在溶劑中;否則,固體不溶於溶劑。
離子固體的穩定性
晶格能的量級決定了離子固體的穩定性。例如,與 $\mathrm{CaCl \:(720\:kJ\:mol^{-1})}$ 相比,$\mathrm{CaCl_2\: (2200\:kJ\:mol^{-1})}$ 更穩定。
結論
在玻恩-哈伯迴圈中,電離能(即所需的能量)和晶格能(即釋放的能量)貢獻最大;它們的符號總是相反的,即它們相互競爭。
如果電離能超過晶格能,這意味著化合物的整體生成是一個吸熱過程,則所得化合物將不穩定,因此不太可能存在。
常見問題
Q1. 何時觀察到玻恩-哈伯迴圈計算出的晶格能值存在差異?
答:當出現以下情況時,玻恩-哈伯迴圈的觀測值和計算值之間存在差異:
(i) 陰離子較大——由於“極化”,例如 $\mathrm{I^-}$
(ii) 陽離子較小且電荷較高,例如 $\mathrm{Be^{+2}, Mg^{+2}, or Al^{+3}}$,由於“部分共價特性”,晶格能值會發生偏差。
Q2. 晶格能如何影響金屬鹵化物的熔點?
答:晶格能越高,分離離子所需的能量就越高,因此離子固體的熔點就越高。
金屬鹵化物的熔點遵循以下順序:
$$\mathrm{LiF\:\gt\:LiCl \:\gt\:LiBr\:\gt\:LiI}$$
$$\mathrm{LiCl\:\gt\:NaCl \:\gt\: KCl\:\gt\: RbCl\:\gt\:CsCl}$$
Q3. 離子固體溶於水的標準是什麼?
只有那些水合能高於晶格能的離子固體才能溶於水。
Q4. 解釋赫斯定律。
答:根據赫斯定律,當反應物轉化為產物時,無論反應是單步進行還是多步進行,焓變都是相同的。赫斯定律用於在玻恩-哈伯迴圈中計算晶格焓。
Q5. 定義晶格能。
答:晶格能 (U) 可以定義為將1摩爾處於標準狀態的晶體固體解離成構成它的氣態離子所需的焓變。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP