氯化鋇
簡介
氯化鋇用化學式 $\mathrm{BaCl_{2}}$ 表示。它是一種無機化合物,外觀呈白色鹽狀。它有毒,並使火焰呈現黃綠色。它很容易透過吸收或吸附來吸引或保持水分子。它更容易溶於水。由於其毒性,它在實驗室和工業中的使用量有限。它在自然狀態下無味且無色。它可溶於水和甲醇,但不可溶於乙醇和乙酸乙酯。它用於苛性氯工廠中鹽水或鹽溶液的提純。有時它也用於製備熱處理鹽,以及鋼的硬化。
什麼是氯化鋇 $\mathrm{BaCl_{2}}$?
氯化鋇,化學式為 $\mathrm{BaCl_{2}}$,是一種無機化合物,外觀呈白色鹽狀或白色固體晶體狀。它高度可溶於水。與大多數其他水溶性鋇鹽類似,它具有劇毒。它使火焰呈現黃綠色。其摩爾質量或分子質量為 208.23 g/mol(無水形式)和 244.26 g/mol(脫水形式)。其密度約為 3.856g/cm3。氯化鋇能夠溶解在甲醇中,但它不溶於乙醇和乙酸乙酯。在其無水形式中,它呈現正交結構。

Aleksander Sobolewski 透過維基共享資源 Kwas jablkowy,CC BY-SA 4.0
氯化鋇 $\mathrm{BaCl_{2}}$ 的結構
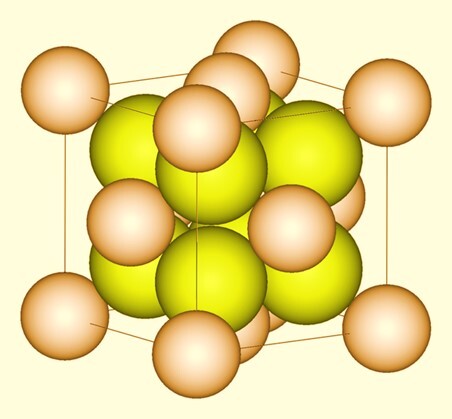
氯化鋇在其無水形式中具有或呈現正交晶體結構,在其二水合物或脫水形式中具有非常罕見的單斜晶體結構。$\mathrm{BaCl_{2}}$ 是鋇離子和氯離子的組合,即 $\mathrm{Ba^{2+}}$ 和 $\mathrm{2Cl^{-}}$。
氯化鋇的製備
以下是製備氯化鋇 $\mathrm{BaCl_{2}}$ 的可能方法:
氯化鋇可以商業化生產,它分兩步製備
從重晶石礦物(硫酸鋇)開始,需要更高的溫度,反應如下所示:
從硫化鋇 (BaS) 開始,它是一種無機化合物,反應如下所示:
原則上,它也可以由氫氧化鋇$\mathrm{(Ba(OH)_{2})}$ 或碳酸鋇$\mathrm{(BaCO_{3})}$. 這些是鹼性鹽,它們可以很容易地與鹽酸$\mathrm{(HCl)}$ 反應生成水合氯化鋇。
$$\mathrm{BaSO_{4}\:+\:4C\:\rightarrow\:BaS\:+\:4CO}$$
$$\mathrm{BaS\:+\:2HCl\:\rightarrow\:BaCl_{2}\:+\:H_{2}S}$$
在這裡,我們也可以使用氯氣來代替 $\mathrm{HCl}$。
氯化鋇 $\mathrm{BaCl_{2}}$ 的性質
以下是氯化鋇的一些基本性質:
氯化鋇的摩爾質量或分子量為 208.23 g/mol(無水形式)和 244.26 g/mol(脫水形式)。
氯化鋇的密度約為 3.856g/cm3(無水形式)。
它大多呈白色固體,但有時也呈白色鹽狀。
氯化鋇的熔點約為 960 °C。
氯化鋇的沸點約為 1560 °C。
溶解度- 它可溶於水,也可溶於甲醇 $\mathrm{(CH_{3}OH)}$,但它不溶於乙醇 $\mathrm{(C_{2}H_{5}OH)}$ 和乙酸乙酯$\mathrm{(C_{4}H_{8}O_{2})}$.
氯化鋇 $\mathrm{BaCl_{2}}$ 的用途
以下是氯化鋇的所有可能用途:
它主要用於苛性氯工廠中鹽水(鹽或鹽溶液)的提純。
它用於低碳鋼或鋼的硬化。
它也用於廢水處理。
它用於製造鉻酸鋇、油潤滑劑等。
它也用於提純和製備熱處理鹽。
它還在不同鋇鹽的形成和某些顏料的生產中發揮著非常重要的作用。
它也用於檢測硫酸根離子的存在。
它用於煙花行業,使爆竹呈現明亮的黃綠色。
化學和物理性質
化學性質:
當我們向氯化鋇溶液中加入硫酸鈉溶液時,氯化鋇會發生複分解反應。反應後,它將在試管底部形成或沉澱出白色沉澱,形成的沉澱為硫酸鋇。該反應形成離子反應,反應如下所示:
眾所周知,氯化鋇像其他二元氯鹽一樣容易與水反應。它在水中解離或分解自身以生成類似 $\mathrm{NaCl}$ 的離子。它表現或表現為中性,因此不影響溶液的 pH 值。反應如下:
$$\mathrm{BaCl_{2}\:+\:Na_{2}SO_{4}\:\rightarrow\:BaSO_{4}(ppt)\:+\:2NaCl}$$
$$\mathrm{BaCl_{2}\:\rightarrow\:Ba^{2+}\:+\:2Cl^{-}}$$
物理性質:
如本文所述,氯化鋇 $\mathrm{(BaCl_{2})}$ 在其無水形式下具有正交晶體結構,在其二水合物或脫水形式下具有單斜晶體結構。
它具有白色晶體狀外觀,其分子量為 208.23 g/mol(無水形式)和 244.26 g/mol(脫水形式)。其密度對於無水形式為 3.856 g/ml,而對於脫水形式為 3.098 g/ml。並且,其熔點和沸點分別為 963 °C 和 1560 °C。
氯化鋇高度或易溶於水和甲醇,但不溶於乙醇和乙酸乙酯。
氯化鋇引起的健康危害
以下是氯化鋇引起的主要健康危害:
眾所周知,氯化鋇劇毒,因此它在工業和實驗室中的使用非常有限。
如果氯化鋇與皮膚接觸,由於其毒性,我們的眼睛、皮膚和粘膜會開始出現刺激。
如果吸入、吞嚥、長時間接觸或經皮吸收,它可能非常危險並導致意識喪失。
如果氯化鋇以毒藥的形式攝入,會嚴重損害腎臟、心血管系統甚至我們的中樞神經系統。
它對水生生物也具有很大的危害性。
匿名 Hazard C,標記為公共領域,更多詳細資訊請訪問 維基共享資源
結論
本文介紹了氯化鋇 $\mathrm{(BaCl_{2})}$,它是一種無機化合物,有時呈白色固體或白色鹽狀。它像許多其他鹽,尤其是鋇鹽一樣劇毒。它也溶於水和甲醇。
當我們將其靠近火焰時,它會發出黃綠色的光。然後,我們討論了氯化鋇在工業或商業水平上的結構和製備方法。我們還了解了它的多種用途,包括鹽水或鹽溶液的提純、廢水處理、鋼的硬化等。最後,我們討論了它的物理和化學性質以及氯化鋇引起的健康危害。
常見問題
1. 什麼是氯化鋇?
氯化鋇是一種無機化合物,分子式或實驗式為 (𝐵𝑎𝐶𝑙2)。它具有白色鹽或白色固體晶體狀外觀。它劇毒。它易於或高度溶於水和甲醇。並且,其摩爾質量或分子量為 208.23 g/mol。
2. 解釋氯化鋇的溶解度?
氯化鋇高度可溶於水和低階醇如甲醇,但它不溶於乙醇和乙酸乙酯。
3. 氯化鋇的熔點和沸點是多少?
氯化鋇的熔點約為 963 °C,氯化鋇的沸點約為 1560 °C。
4. 列舉氯化鋇的一些用途。
氯化鋇的一些用途如下所示:
它用於在苛性氯工廠中提純鹽水(鹽溶液)。
它也用於廢水處理過程。
它用於鋼的硬化。
5. 鹽水是什麼意思?
鹽水是普通鹽$\mathrm{(NaCl)}$ 或氯化鈉的高濃度水溶液。它在商業上是普通鹽和其他鹽的重要來源。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP